Compuesto de organoplomo
Los compuestos de organoplomo son compuestos químicos que contienen un enlace químico entre carbono y plomo. La química de organoplomo es la ciencia que estudia sus propiedades químicas y reactividad. El primer compuesto de organoplomo, hexaetildiplomo, fue sintetizado en 1858.[1] El plomo es tetravalente, compartiendo el grupo 14 de la tabla periódica con el carbono, el silicio, el germanio y el estaño.
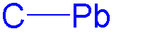
Características del enlace C-Pb
editarAl bajar por el grupo de los carbonoideos, comparando el enlace de dichos elementos con el carbono, C-X (donde X= C, Si, Ge, Sn, Pb) se observa que el enlace se vuelve cada vez más débil y la longitud de enlace cada vez mayor. El enlace C-Pb en el tetrametilplomo mide 222 pm de largo con una energía de disociación de 49 kcal/ mol (204 kJ/mol). Por comparación, el enlace C-Sn en el tetrametilestaño mide 214 pm de largo con una energía de disociación de 71 kcal/mol (297 kJ/mol).
El predominio del Pb (IV) en la química de organoplomo es notable, mientras los compuestos inorgánicos de plomo tienden a tener centros de Pb (II). La razón es que en los compuestos inorgánicos de plomo, este se une a elementos tales como nitrógeno, oxígeno y haluros que tienen una mayor electronegatividad que el propio plomo y la carga parcial positiva sobre el plomo lleva a una contracción más fuerte del orbital 6s que del orbital 6p, lo que hace inerte al orbital 6s.[2]
Con mucho, el compuesto de organoplomo más importante es el tetraetilo de plomo utilizado como agente antidetonante. Los reactivos de plomo más importantes para introducir el plomo son el tetraacetato de plomo y el cloruro de plomo.
El uso de compuestos orgánicos de plomo está limitado, en parte debido a su toxicidad, aunque sea sólo el 10% de la toxicidad de los compuestos de paladio.[1]
Síntesis
editarLos compuestos orgánicos de plomo pueden derivar de reactivos de Grignard y cloruro de plomo. Por ejemplo, el cloruro de metilmagnesio reacciona con el cloruro de plomo para dar tetrametilplomo, un líquido transparente como el agua con punto de ebullición de 110 °C y una densidad de 1,995 g/cm³. La reacción de un compuesto de plomo (II) con ciclopentadienuro de sodio forma el metaloceno de plomo, llamado plumboceno.
Ciertos arenos reaccionan directamente con tetraacetato de plomo para dar compuestos de arilplomo en una sustitución aromática electrófila. Por ejemplo una reacción entre anisol con tetraacetato de plomo forma triacetato de p-metoxifenilplomo en cloroformo y ácido dicloroacético:[3]
Otros compuestos de plomo son los haluros de organoplomo de fórmula general RnPbX(4-n), los sulfinatos de organoplomo (RnPb(OSOR)(4−n)) y los hidróxidos de organoplomo (RnPb(OH)(4−n)).
Algunas reacciones típicas son:[4]
- Con ácido clorhídrico forman cloruros de organoplomo
- Con dióxido de azufre forman sulfinatos de organoplomo
- Con óxido de plata forman hidróxidos de organoplomo
- Con bases fuertes forman dihidróxidos
Los compuestos R2Pb(OH)2 son anfóteros. Con valores de pH inferior a 8 forman iones R2Pb2+ y con un pH superior a 10, forman iones R2Pb(OH)3-.
Otros derivados de los hidróxidos son los plumboxanos:
- 2 R3PbOH + Na → (R3Pb)2O + NaOH + 1/2 H2
que dan lugar a alcóxidos poliméricos:
- (R3Pb)2O + R'OH → 1/n (R3PbOR')n - n H2O
Reacciones
editarEl enlace C-Pb es débil y por esta razón es fácil la ruptura homolítica de los compuestos de organoplomo formando radicales libres. Cuando actúan como antidetonantes, su finalidad es la de un iniciador de radicales. Los tipos generales de reacción de los compuestos de arilorganoplomo o de vinilorganoplomo son la transmetalación, por ejemplo, con ácidos bóricos y la división heterocíclica catalizada por ácido. Los compuestos de organoplomo se emplean en reacciones de acoplamiento entre compuestos areno. Son más reactivos que los compuestos organoestánnicos y por lo tanto puede ser utilizados para la síntesis de biarilos estéricamente impedidos.
En la oxiplumbación, los alcóxidos de organoplomo se adicionan a los alquenos polares:
- H2C=CH-CN + (Et3PbOMe)n → MeO-CH2-HC(PbEt3)-CN → MeO-CH2-CH2-CN
El alcóxido se regenera en la metanólisis posterior y por lo tanto actúa como un catalizador.
Triacetatos de arilplomo
editarEl átomo de plomo sustituyente en el triacetato de p-metoxifenilplomo se desplaza por carbonos nucleófilos como el derivado del fenol 2,4,6-trimetilfenol(mesitol) exclusivamente en la posición orto.[5]
La reacción requiere la presencia de un gran exceso de una amina de coordinación como la piridina que, presumiblemente, se une al plomo en el curso de la reacción. La reacción es insensible a los depuradores de radicales (scavengers), y por lo tanto, se puede descartar un mecanismo radicalario. El mecanismo de reacción es probable que incluya desplazamiento nucleófilo del grupo acetato por el grupo fenólico a un intermedio de diorganoplomo que pueden ser aislados en algunas reacciones relacionadas. El segundo paso es entonces semejante a una reordenación de Claisen, salvo que la reacción depende de la electrofilia (de ahí la preferencia orto) del fenol.
El nucleófilo también puede ser el carbanión de un compuesto β-dicarbonilo:[3]
El carbanión se forma por la abstracción de protones del α-protón ácido por la piridina (que cumple una doble función) similar a la condensación de Knoevenagel. Este intermedio desplaza un ligando acetato a un compuesto de diorganoplomo y otra vez estos intermediarios pueden ser aislados con reactivos apropiados como productos intermedios inestables. El segundo paso es una eliminación reductiva con la formación de un nuevo enlace C-C y de acetato de plomo (II).
Reactivos intermediarios
editarLos compuestos de organoplomo forman diversos reactivos intermediarios, como radicales libres plomo :
- Me3PbCl + Na (77 K) → Me3Pb.
y plumbilenos, compuestos análogos a los carbenos, con plomo en lugar de carbono:
- Me3Pb-Pb-Me3 → [Me2Pb]
- [Me2Pb] + (Me3Pb)2 → Me3Pb-Pb(Me)2-PbMe3
- Me3Pb-Pb(Me)2-PbMe3 → Pb(0) + 2 Me4Pb
Estos intermediarios se destruyen por desproporcionación.
Los plumbilidinos del tipo RPb (formalmente plomo con estado de oxidación 1+, Pb (I)) son ligandos para otros metales en compuestos del tipo LnMPbR (compárense con los carbinos metálicos de carbono).
Véase también
editarEnlaces químicos del carbono con el resto de átomos
editar| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
editar- ↑ a b Main Group Metals in Organic Synthesis Yamamoto, Hisashi / Oshima, Koichiro (eds.) 2004 ISBN 3-527-30508-4
- ↑ Synthesis of Organometallic Compounds: A Practical Guide Sanshiro Komiya Ed. 1997
- ↑ a b Robert P. Kozyrod and John T. Pinhey (1990). "The C-arylation of β-dicarbonyl compounds". Org. Synth.; Coll. Vol. 7: 229.
- ↑ Elschenbroich, C.; Salzer, A. ”Organometallics : A Concise Introduction” (2nd Ed) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ↑ Pinhey, J. T. (1996). «Organolead(IV) triacetates in organic synthesis». Pure Appl. Chem. 68 (4): 819. doi:10.1351/pac199668040819.
Lecturas adicionales
editar- Organoplomo. En: Química Organometálica. Didier Astruc, Frederic Astruc. Editorial Reverté, 2003. ISBN 8429170073. Pág. 338
- Abadin, H.G.; Pohl, H.R. (2010). «Alkyllead compounds and their environmental toxicology». Metal ions in life sciences (Cambridge: RSC publishing). 7, Organometallics in environment and toxicology: 153-164. ISBN 9781847551771.