Sec-butil-litio
El sec-butil-litio es un compuesto organometálico de fórmula química CH3CHLiCH2CH3, abreviado sec-BuLi o s-BuLi. Este reactivo de organolitio quiral se utiliza como fuente del carbanión sec-butilo en síntesis orgánica.[2]
| sec-Butil litio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| sec-Butil litio | ||
| General | ||
| Símbolo químico | sec-BuLi | |
| Fórmula estructural |
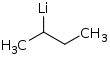 | |
| Fórmula molecular | C4H9Li | |
| Identificadores | ||
| Número CAS | 598-30-1[1] | |
| ChemSpider | 10254345 | |
| PubChem | 102446 | |
| UNII | 5YV3GII1TB | |
| Propiedades físicas | ||
| Masa molar | 6406 g/mol | |
| Punto de ebullición | 90 °C (363 K) | |
| Propiedades químicas | ||
| Acidez | 51 pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
editarEl sec-BuLi se puede preparar mediante la reacción de haluros de sec-butilo, como el 2-clorobutano, con litio metálico:[3]
El enlace carbono-litio es muy polar, lo que hace que el carbono sea básico, como en otros reactivos de organolitio. El sec-butil-litio es más básico que el reactivo primario de organolitio, el n-butil-litio. También está más impedido estéricamente, aunque sigue siendo útil para las síntesis.
Propiedades químicas
editarLa basicidad aumenta en la serie n-butil-litio < sec-butil-litio < terc-butil-litio. El s-BuLi es, por lo tanto, la segunda base más fuerte de esta serie. El s-butil-litio está disponible comercialmente, generalmente como una disolución en ciclohexano. Puede formarse un precipitado fino de hidruro de litio durante el almacenamiento, lo cual conduce a una reducción en la concentración de las disoluciones a lo largo del tiempo:[4][5]
Esta reacción produce una mezcla de s-BuLi con 1-buteno, cis-2-buteno y trans-2-buteno.
El sec-BuLi es autoinflamable con el aire y también reacciona violentamente con el agua. Por lo tanto, el reactivo siempre debe almacenarse y manipularse bajo gas protector (como el argón).
Aplicaciones
editarEl sec-BuLi se emplea para desprotonaciones de ácidos carbonados particularmente débiles donde el reactivo más convencional (n-BuLi) no es satisfactorio. Sin embargo, es tan básico que su uso requiere un mayor cuidado que para el n-BuLi. Por ejemplo , el éter dietílico es atacado por el sec-BuLi a temperatura ambiente en minutos, mientras que las disoluciones de n-BuLi en éter son estables.[2] Muchas transformaciones que involucran al sec-butil-litio son similares a las que involucran a otros reactivos de organolitio. Por ejemplo, el sec-BuLi reacciona con compuestos carbonílicos y ésteres para formar alcoholes.
Referencias
editar- ↑ Número CAS
- ↑ a b Ovaska, T. V. "s-Butyllithium" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons: New York. doi 10.1002/047084289X.rb397.
- ↑ Hay, D. R.; Song, Z.; Smith, S. G.; Beak, P. (1988). «Complex-induced proximity effects and dipole-stabilized carbanions: kinetic evidence for the role of complexes in the α-lithiations of carboxamides». J. Am. Chem. Soc. 110 (24): 8145-8153. doi:10.1021/ja00232a029.
- ↑ W. H. Glaze, J. Lin, E. G. Felton: The Thermal Decomposition of sec.-Butyllithium. J. Org. Chem. 30, 1965, S. 1258–1259, doi:10.1021/jo01015a514.
- ↑ W. H. Glaze, J. Lin, E. G. Felton: The Pyrolysis of Unsolvated Alkyllithium Compounds. J. Org. Chem. 31, 1966, S. 2643–2645, doi:10.1021/jo01346a044.