Cáncer de mama
El cáncer de mama, conocido también como cáncer de seno o cáncer de las glándulas mamarias, es una proliferación maligna de las células epiteliales que revisten los conductos o conductos. Es una enfermedad clonal; donde una célula individual producto de una serie de mutaciones somáticas o de línea germinal adquiere la capacidad de dividirse sin control, ni orden, haciendo que se reproduzca hasta formar un tumor. El tumor resultante, que comienza como anomalía leve, pasa a ser grave, invade tejidos vecinos y finalmente, se propaga a otras partes del cuerpo. El cáncer no tratado a tiempo produce muerte.
| Cáncer de mama | ||
|---|---|---|
 Crecimiento de células malignas en el tejido mamario | ||
| Especialidad | oncología | |
| Síntomas | Un bulto en un seno, un cambio en la forma del seno, hoyuelos en la piel, líquido del pezón, un pezón recién invertido, una mancha roja y escamosa de piel en el seno | |
| Factores de riesgo | Ser mujer, obesidad, falta de ejercicio, alcohol, terapia de reemplazo hormonal durante la menopausia, radiación ionizante, primera menstruación a edad temprana, tener hijos a una edad avanzada o no tener hijos, edad avanzada, cáncer de mama previo, antecedentes familiares de cáncer de mama, síndrome de Klinefelter | |
| Tratamiento | Cirugía, radioterapia, quimioterapia, terapia hormonal | |
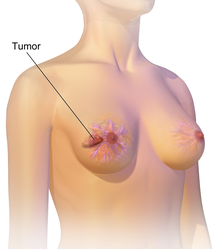
Existen dos tipos principales de cáncer de mama. El carcinoma ductal infiltrante, que comienza en los conductos que llevan leche desde la mama hasta el pezón, es por mucho el más frecuente (aproximadamente el 80 % de los casos). El segundo lugar lo ocupa el carcinoma lobulillar infiltrante (10 a 12 % de los casos), que comienza en partes de las mamas llamadas lobulillos, que producen la leche materna.[1] Los restantes tipos de cáncer de mama no superan en conjunto el 10 % de los casos.
Los principales factores de riesgo de contraer cáncer de mama incluyen ser mujer (aunque también puede darse en hombres), una edad avanzada, la primera menstruación a temprana edad, edad avanzada en el momento del primer parto o nunca haber dado a luz, antecedentes familiares de cáncer de mama, el hecho de consumir hormonas tales como estrógeno y progesterona.[2] Estudios recientes demuestran la asociación del cáncer de mama con la sobreproducción de zonulina en el intestino y el consiguiente aumento de la permeabilidad intestinal.[3][4] Entre 5 a 10 % de los casos, el cáncer de mama es causado por mutaciones genéticas heredadas.
Para detectar el cáncer de mama, se utilizan diferentes pruebas como la mamografía, ultrasonido mamario con transductores de alta resolución (ecografía), o imágenes por resonancia magnética. El diagnóstico de cáncer de mama solo puede adoptar el carácter definitivo por medio de una biopsia mamaria.
Del total de los carcinomas de mama, menos del 1 % ocurren en varones. El Día Internacional del Cáncer de Mama se celebra el 19 de octubre,[5] tiene como objetivo sensibilizar a la población general acerca de la importancia que esta enfermedad tiene en el mundo industrializado.
Historia
editarEl cáncer de mama es uno de los cánceres tumorales que se conoce desde antiguas épocas. La descripción más antigua del cáncer (aunque sin utilizar el término «cáncer») proviene de Egipto, del 1600 a. C. aproximadamente.
El papiro Edwin Smith[6] describe 8 casos de tumores o úlceras del cáncer que fueron tratados con cauterización, con una herramienta llamada "la horquilla de fuego". El escrito dice sobre la enfermedad: «No existe tratamiento» cuando el tumor es sangrante, duro e infiltrante. A lo mínimo un caso descrito es de un hombre. También se hacen descripciones en el antiguo Egipto y en el papiro Ebers.[7][8] Más tarde Hipócrates describe varios casos y apunta que las pacientes con el cáncer extendido y profundo no deben ser tratadas pues viven por más tiempo.[7] En su obra Enfermedades de la mujer, Hipócrates prestó atención al karkinoma de mama avanzado.[9]
El médico Galeno fue el primero en utilizar el término «cáncer», del latín cancrum, por la asociación con los cangrejos.[9] Las ideas de Galeno eran diferentes de las de Hipócrates y los egipcios. Aulo Cornelio Celso en el siglo I y Galeno en el siglo II refirieron la extirpación de los tumores mamarios y el uso del cauterio para la cirugía mamaria.[9] Celso creía que una intervención imprudente sobre el cáncer podría ser dañina y exasperar el tumor.[8] Se atribuye a Leónidas de Alejandría, médico griego, el primer procedimiento quirúrgico registrado para el cáncer de mama, antecedente de la moderna mastectomía.[9] Con eso se distanciaba de los tratamientos o medicaciones usadas comúnmente hasta entonces, como baños tibios o aceite de ricino, entre otros. Además, Leónidas señaló la retracción del pezón como signo de malignidad para un tumor mamario.[8] En el siglo VI, Aecio de Amida señaló la posibilidad de que en el cáncer de mama coexistan tumefacciones satélites en el hueco axilar.[8] En el siglo VII, el cirujano bizantino Pablo de Egina buscó perfeccionar la técnica de extirpación del cáncer de mama mediante el raspado de los ganglios de la axila.[8] Existen diferentes tipos de cáncer de mama, que se clasifican según el lugar donde se originan y cómo se comportan. Algunos de los tipos más comunes incluyen:
Carcinoma ductal invasivo: Es el tipo más común de cáncer de mama. Comienza en los conductos de la mama y puede diseminarse a tejidos cercanos.
Carcinoma lobulillar invasivo: Se origina en los lóbulos de la mama y puede propagarse a otras áreas del cuerpo.
Además de estos tipos principales, existen otros menos comunes, como el carcinoma inflamatorio de mama y el carcinoma medular de mama.
Los factores de riesgo para el cáncer de mama incluyen antecedentes familiares de la enfermedad, edad avanzada, exposición prolongada a hormonas femeninas, obesidad, consumo de alcohol, entre otros. Sin embargo, muchas mujeres diagnosticadas con cáncer de mama no presentan ninguno de estos factores de riesgo conocidos.
El diagnóstico temprano es fundamental para el tratamiento exitoso del cáncer de mama. Se recomienda que las mujeres se realicen autoexámenes regulares de las mamas y se sometan a mamografías periódicas, especialmente después de los 40 años. Otros métodos de diagnóstico incluyen ecografías mamarias, resonancias magnéticas y biopsias.
El tratamiento del cáncer de mama puede incluir cirugía, radioterapia, quimioterapia, terapia hormonal y terapias dirigidas. El enfoque de tratamiento depende del tipo y estadio del cáncer, así como de otros factores individuales.
Por siglos los médicos han descrito casos similares, todos teniendo una triste conclusión. No fue sino hasta que la ciencia médica logró mayor entendimiento del sistema circulatorio en el siglo XVII que se lograron felices avances. En este siglo se pudo determinar la relación entre el cáncer de mama y los nódulos linfáticos axilares. El cirujano francés Jean Louis Petit (1674-1750), con su remoción de los nódulos linfáticos, y posteriormente el cirujano Alfredo Velpeau (1795-1867), abrieron el camino a la mastectomía moderna.[10] Alfredo Velpeau es el autor de la obra más importante en esta materia de su época: Tratado de las enfermedades del seno y de la región mamaria.[10] Su senda de comprensión y avance fue seguida por William Stewart Halsted que inventó la operación conocida como "mastectomia radical de Halsted", procedimiento popular hasta fines de la década de 1970.
Epidemiología
editarDesde hace varias décadas, el cáncer de mama se ha incrementado en grado notable alrededor del mundo, sobre todo en países occidentales.[11] y este crecimiento permanece, a pesar de que existen mejores instrumentos de diagnóstico, diversos programas de detección temprana, mejores tratamientos y mayor conocimiento de los factores de riesgo.[12] El tratamiento del cáncer de mama puede incluir cirugía, radioterapia, quimioterapia, terapia hormonal y terapias dirigidas.
El cáncer de mama es la neoplasia maligna más frecuente en la mujer occidental y la principal causa de muerte por cáncer en la mujer en Europa, Estados Unidos, Australia y algunos países de América Latina.[13]
A partir de 2006 este padecimiento ocupa el primer lugar de mortalidad por neoplasia en las mujeres mayores de 25 años, desplazando al cáncer cervicouterino, causando cerca de quinientas mil muertes cada año de las cuales el 70 % ocurre en países en desarrollo, aunque el riesgo de morir es mayor entre las mujeres que habitan países pobres, debido a un menor acceso a los servicios de salud para la detección temprana, tratamiento y control. En el año 2010 la tasa estandarizada de mortalidad fue de 18,7 por cien mil mujeres de 25 y más años, lo que representa un incremento del 49,5 % en los últimos 20 años.
El cáncer mamario representa 31 % de todos los cánceres de la mujer en el mundo. Aproximadamente 43 % de todos los casos registrados en el mundo en 1997 corresponden a los países en vías de desarrollo.[14] La incidencia está aumentando en América Latina y en otras regiones donde el riesgo es intermedio (Uruguay, Canadá, Brasil, Argentina, Puerto Rico y Colombia) y bajo (Ecuador, Costa Rica y Perú).[14]
Con base en un análisis estadístico del año más reciente para el cual existen datos en cada país, son cinco los países donde la mortalidad anual por cada 10 000 mujeres es mayor: Uruguay (46,4), Trinidad y Tobago (37,2), Canadá (35,1), Argentina (35,2) y los Estados Unidos (34,9).[14]
|
Clasificación
editar| Subtipo histológico | Frecuencia (%) | |
|---|---|---|
| Fibroadenoma (benigno) | 7-12% | |
| Tumor filoide (maligno) | 0,5-2% | |
| Sarcoma | Angiosarcoma | <0,1% |
| Rabdomiosarcoma | Raro | |
| Leiomiosarcoma | Raro | |
| Condrosarcoma | Raro | |
| Osteosarcoma | Raro | |
| Tumores epiteliales (benignos) |
Papiloma intraductal | 0,4% |
| Adenoma del pezón | Raro | |
| Papilomatosis del pezón (benigno) | Raro | |
| Carcinoma invasivo (malignos) |
Carcinoma ductal infiltrante | 80% |
| Carcinoma lobulillar infiltrante o invasor | 10% | |
| Carcinoma medular | 5% | |
| Carcinoma mucinoso o coloide | 2% | |
| Carcinoma papilar infiltrante | 2% | |
| Carcinoma tubular | 2% | |
| Carcinoma ductal in situ (<5%) |
Comedocarcinoma | |
| Tipo sólido | ||
| Tipo cribriforme | ||
| Tipo micropapilar | ||
| Carcinoma papilar in situ | ||
| Enfermedad de Paget de seno | ||
| Carcinoma ductal in situ microinvasivo | ||
| Carcinoma lobular 'in situ' | ||
En medicina el cáncer de mama se conoce con el nombre de carcinoma de mama. Es una neoplasia maligna que tiene su origen en la proliferación acelerada e incontrolada de células que tapizan, en 90 % de los casos, el interior de los conductos que durante la lactancia, llevan la leche desde los acinos glandulares, donde se produce, hasta los conductos galactóforos, situados detrás de la areola y el pezón, donde se acumula en espera de salir al exterior. Este cáncer de mama se conoce como carcinoma ductal. En el 10 % de los casos restantes el cáncer tiene su origen en los propios acinos glandulares y se le llama carcinoma lobulillar. El carcinoma ductal puede extenderse por el interior de la luz ductal e invadir el interior de los acinos en lo que se conoce como fenómeno de cancerización lobular.
El cáncer de mama ha sido clasificado sobre la base de diferentes esquemas.
Etiología
editarAtendiendo al origen existen tres tipos genéricos de cáncer de mama:
- Esporádico: sin antecedentes familiares. Serían entre el 70 y el 80% de los casos.
- Familiar: con antecedentes familiares, pero no atribuibles a la mutación de un solo gen, sino a la contribución de muchos genes (herencia poligénica o multifactorial). 15-20%.
- Hereditario: atribuidos a mutaciones por línea germinal de un solo gen (herencia monogénica). Solo serían entre 5-10%. Dentro de estos, el 40% se debe a mutaciones en BRCA1 y BRCA2 (Breast Cancer susceptibility gen/protein)
Estadificación
editarEl sistema de estadificación TNM para el cáncer de mama se basa en el tamaño del tumor (T), si el tumor se ha diseminado a los ganglios linfáticos (N), en las axilas o aún no se ha diseminado, y si el tumor se ha metastatizado (M) (es decir, si se ha propagado a una región más distante del cuerpo).[19] Los tumores de mayor tamaño, de propagación nodal y metastásicos tienen un mayor número de estadiaje y un peor pronóstico.
La estadificación principal incluye:[20]
- Estadio 0: es una enfermedad pre-maligna o con marcadores positivos (a veces llamada CDIS: carcinoma ductal in situ). Sería el momento en que la célula se ha transformado recientemente en cancerígena, pero todavía no ha roto la membrana basal.
- Estadio 1: las células cancerígenas ya han superado la membrana basal, pero el tumor no supera los 2 cm de tamaño.
- Estadio 2: semejante al estadio 1 pero el tumor ya es mayor de 2 cm, pero no más de 5 cm ya que no se ha diseminado todavía a los ganglios linfáticos.
- Estadio 3: dentro de este estadio se tienen distintos clasificaciones en función del tamaño de la masa tumoral y de si los nódulos linfáticos están afectados o no.
Los estadios 1-3 se definen como los 'inicios' del cáncer y son potencialmente curables por ser en muchos casos operables.
- El estadio 4 se define como cáncer en etapa 'avanzada' y/o cáncer metastásico porque el cáncer se diseminó hasta otros órganos del cuerpo. Este tipo de cáncer metastatiza con mayor frecuencia en los huesos, los pulmones, el hígado o el cerebro y tiene un mal pronóstico.
Anatomía patológica
editarLa mayoría de los cánceres de mama derivan de la unidad ducto-lobulillar.[21] Las células cancerígenas derivadas de otros tejidos se consideran infrecuentes en el cáncer de mama. El término «Carcinoma in situ» se refiere al tipo de cáncer que se encuentra confinado en la luz de los ductos o de los lobulillos glandulares, sin invadir los tejidos vecinos.[2] Por su parte, el carcinoma invasivo prolifera en demasía hasta romper la llamada membrana basal y extenderse infiltrando los tejidos que rodean a los ductos y lobulillos mamarios, penetrando así el tejido circundante. Las células que se dividen más rápidamente tienen un peor pronóstico. Una forma de medir el crecimiento de células de un tumor es con la presencia de la proteína Ki67, que indica que la célula se encuentra en fase S de su desarrollo y también indica la susceptibilidad a ciertos tratamientos.
Factores pronósticos
editarClásicos
editar- Estado de los nódulos linfáticos: en caso de que estuvieran contaminados sería signo de un mal pronóstico.
- Tamaño del tumor: en general un tumor grande suele ir ligado a un mal pronóstico, aunque no siempre es así, ya que en realidad es más importante la capacidad de invasión.
- Estado proliferativo: a mayor proliferación peor prognosis. Este parámetro puede estudiarse realizando análisis histológicos (con tinción con hematoxilina y eosina (HE), por análisis inmunohistológico (Ki67) o análisis por FACS (en el que se estudien las células en fase S)
- Grado histológico: para determinarlo se tiene en cuenta una combinación de varios factores como son la estructura de los túbulos (más o menos definida), el estado proliferativo (% de células mitóticas) y el pleomorfismo nuclear (número, forma y tamaño de núcleos y nucleólos). Existen dos sistemas para clasificar el cáncer de mama según el grado histológico: el sistema SBR Scarff-Bloom-Richardson (EE. UU.) y el sistema de Nottingham (Europeo) que no es más que el SBR modificado por Elston y Ellis. La diferencia entre ambos sistemas serían los límites de cada parámetro entre cada grado.
Sensibilidad a receptores
editarTodas las células tienen receptores en su superficie, en su citoplasma y el núcleo celular. Ciertos mensajeros químicos tales como las hormonas se unen a dichos receptores y esto provoca cambios en la célula. En el cáncer de mama hay tres receptores que son usados como marcadores tumorales: receptor de estrógeno (ER), receptor de progesterona (PR) y el oncogén HER2/neu. Las células que tengan alterada la expresión de alguno de estos receptores se les coloca un signo positivo y un signo negativo si no se produce. Aquellas células que no sobre-expresen ninguno de estos receptores se denominan basales o triple negativos. Todos de estos receptores son identificados por inmuno-histoquímica y genética molecular.
- (ER+/PR+) cáncer positivo para receptores de estrógenos y progesterona: en torno al 70 % de los cánceres de mama son sensibles a los estrógenos, lo cual significa que el estrógeno hace que el tumor canceroso mamario crezca. El cáncer de mama ER+ pueden ser tratado con terapia adyuvante mediante medicamentos que bloquean la activación de los receptores de estrógeno (SERMs), como el tamoxifeno, o bien con inhibidores de aromatasa (Ais), como el anastrol. Este tipo de terapia se combina con cirugía y puede ir o no, seguida de un tratamiento con quimioterapia.[cita requerida]
- Aproximadamente 30% de las pacientes con cáncer de mama tienen lo que se conoce como cáncer de mama positivo para HER2.[19][22] HER2 se refiere a un oncogén que ayuda a que las células crezcan, se dividan y se reparen ellas mismas. Cuando las células tienen demasiadas copias de este gen, las células (incluyendo las cancerosas) se multiplican más rápidamente. Los expertos piensan que las mujeres con cáncer de mama positivo para HER2 tienen una enfermedad más agresiva, tienen una mayor resistencia a los tratamientos convencionales de quimioterapia y un riesgo mayor de recurrencia que aquellas que no tienen este tipo de cáncer.[22] Sin embargo el cáncer de mama HER2+ responde a los medicamentos tales como el anticuerpo monoclonal, trastuzumab—en combinación con la quimioterapia convencional— y esto ha mejorado el pronóstico significativamente.[22]
El estado de receptor se utiliza para dividir el cáncer de mama en cuatro clases moleculares:
- Subtipo basal-epitelial (o basocelular): caracterizado por la ausencia o mínima expresión de receptor de estrógeno (RE) y HER2 (triple negativo), elevada expresión de citoqueratinas 5/6 y 17 (mioepiteliales), laminina, y proteína 7 de unión a ácidos grasos. A diferencia de otros subtipos, este grupo de tumores presenta alta frecuencia (82 %) de mutaciones en TP53 (en tirosina) y expresión de proteína p53 (TP53 funciona como punto de control (checkpoint) en el ciclo celular desencadenando respuestas ante el daño sobre el ADN, incluyendo reparación y apoptosis). Los tumores de tipo basal reciben este nombre por su perfil de expresión genómica similar a la de un epitelio celular basal normal y a las células mioepiteliares mamarias normales. También comparte características histológicas con las células epiteliares basales de la mama normal, y muestra una tasa proliferativa elevada, necrosis central y margen infiltrativo, así como estroma escaso, frecuentes células apoptóticas y respuesta estromal linfocítica, características similares a las también observadas en los carcinomas que aparecen en mujeres portadoras de mutación en el gen BRCA1.[23]
- Subtipo HER2+: ausencia o mínima expresión de RE, elevada expresión de HER2. El perfil de expresión revela no solo copias aumentadas de ARNm de HER2/neu, sino también un aumento en la transcripción de otros genes adyacentes que están amplificados en este segmento de ADN, como GRB7.
- Luminal A: caracterizado por la elevada expresión de RE, proteína 3 de unión a GATA, proteína de unión a caja-X, factor 3, factor nuclear 3 alfa de hepatocito y LIV-1 regulada por estrógeno. Comparte características con las células epiteliales luminales que se desarrollan a partir de la capa interna de revestimiento del ducto mamario.
- Luminal B y C: expresión baja a moderada de genes específicos de perfil luminar incluyendo los de grupo de RE.[24]
Por último, el estado de receptor ha convertido en una evaluación crítica de todos los cánceres de mama, ya que determina la idoneidad del uso de tratamientos específicos, por ejemplo, tamoxifeno y/o trastuzumab. Ahora, estos tratamientos son algunos de los tratamientos adyuvantes más eficaces del cáncer de mama. Por el contrario, cáncer de mama negativos triple (es decir, no receptores positivos) ahora se piensa que puede ser un indicativo de mal pronóstico.
Perfil de expresión génica
editarLa heterogeneidad biológica del cáncer de mama tiene implicaciones para el pronóstico y para la toma de decisiones terapéuticas. Una nueva aproximación en la clasificación del cáncer de mama mediante el análisis de expresión de múltiples genes en un tumor individual ayudará en la obtención de mejores clasificaciones para los tumores (por conocer mejor su origen) y con ello mejorar la capacidad pronóstica y así elegir un tratamiento más personalizado y efectivo.[25]
Las nuevas tecnologías de micromatrices como los microarray permiten detectar y cuantificar simultáneamente la expresión de numerosos genes, ya que permiten el estudio simultáneo de una gran batería de genes.
Los chips de ADN son capaces de distinguir las células normales de las células del cáncer de mama, encontrando diferencias en cientos de genes, aunque se desconoce la importancia de la mayoría de esas diferencias. Varias pruebas de detección se encuentran disponibles comercialmente, pero la evidencia para su valor es limitada. La marca Oncotype DX es la única prueba respaldada por pruebas de nivel II, que no ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), pero está avalada por la American Society of Clinical Oncology. La marca MammaPrint ha sido aprobada por la FDA, pero solo es compatible con el nivel III de evidencias. Dos otras pruebas tienen pruebas de nivel III: Theros y MapQuant Dx.
Factores de riesgo
editarHoy en día, el cáncer de mama, como otras formas de cáncer, es considerado el resultado de daño ocasionado al ADN. Este daño proviene de muchos factores conocidos o hipotéticos (tales como la exposición a radiación ionizante). Algunos factores como la exposición a estrógenos llevan a un incrementado rango de mutación, mientras que otros factores como los oncogenes BRCA1, BRCA2, y p53 causan reparo disminuido de células dañadas.
Los humanos no son los únicos mamíferos capaces de desarrollar cáncer de mama.[26] Las perras,[27] gatas[28] y algunos tipos de ratones, principalmente el ratón doméstico, son susceptibles de desarrollar cáncer de mama que se sospecha es causado por mutagénesis insercional aleatoria por el virus del cáncer de mama en el ratón (MMTV). La sospecha de la existencia de origen viral del cáncer de mama es controversial, y la idea no es mayormente aceptada por la falta de evidencia definitiva o directa. Hay mucha mayor investigación en el diagnóstico y tratamiento del cáncer que en su causa de origen.
Edad
editarEl riesgo de padecer cáncer de mama se incrementa con la edad ya que la mayoría de las veces se detecta cuando la mujer alcanza los 50 años o posteriores a ellos[29], pero el cáncer de mama tiende a ser más agresivo cuando ocurre en mujeres jóvenes.[26] La mayoría de los casos de cáncer de mama avanzado se encuentran en mujeres de más de 50 años. Las mujeres tienen 100 veces más probabilidades de sufrir cáncer de mama que los hombres.[1]
Para una mujer que vive más allá de los 90 años la probabilidad de tener cáncer de mama durante toda su vida es de 12,5 % o 1 en 8.
Un tipo de cáncer de mama que ocurre y es especialmente agresivo y desproporcional en las mujeres jóvenes es el cáncer de mama inflamatorio. Suele ser descubierto en el estadio III o estadio IV. También es característico porque normalmente no se presenta con masa por lo tanto no es detectado con mamografía o ecografía. Se presenta con los signos y síntomas de una mastitis.
Mutaciones genéticas
editarAunque es más frecuente que sean factores externos los que predisponen a una mujer al cáncer de mama, un pequeño porcentaje conlleva una predisposición hereditaria a la enfermedad.
Dos genes, el BRCA1 y el BRCA2, han sido relacionados con una forma familiar rara de cáncer de mama.[30] Las mujeres cuyas familias poseen mutaciones en estos genes tienen un riesgo mayor de desarrollar cáncer de mama. No todas las personas que heredan mutaciones en estos genes desarrollarán cáncer de mama. Conjuntamente con la mutación del oncogén p53 característica del síndrome de Li-Fraumeni estas mutaciones determinarían aproximadamente el 40 % de los casos de cáncer de mama hereditarios (5-10 % del total), sugiriendo que el resto de los casos son esporádicos. Recientemente se ha encontrado que cuando el gen BRCA1 aparece combinado con el gen BRCA2 en una misma persona, incrementa su riesgo de cáncer de mama incluso en un 87 %.[31]
Se han verificado otros cambios genéticos asociados a determinados datos clínicos de cáncer de mama, por lo que no solo se utilizan como marcadores moleculares, sino también como factores pronósticos y predictivos. Por ejemplo, las mutaciones en el gen TP53 suele estar relacionado con niveles altos en el biomarcador Ki67, tumores luminales B y alto grado histológico. Este tipo de mutaciones suele ir unida a resistencia a tratamiento con inhibidores de aromatasa, hecho muy importante a la hora de elegir un tratamiento adecuado para el paciente. Del mismo modo una mutación importante a nivel predictivo (positivo para terapia con Ais)en cáncer de mama luminal, aunque no muy abundante, sería la concerniente a GATA3. Además para cánceres de tipo luminal A, con bajo índice de proliferación (Ki67)se han detectado mutaciones en los genes MAP3K1 y MAP4K2 (diana del primero) que estarían asociados a un buen pronóstico y que explicarían, debido a sus dianas (ERK o JNK) la insensibilidad por pérdida de señalización o la acumulación de mutaciones.[32]
Otros cambios genéticos que aumentan el riesgo del cáncer de mama incluyen mutaciones del gen PTEN (síndrome de Cowden), STK11 (síndrome de Peutz-Jeghers) y CDH1 mutado en el 50.5 % de los tumores lobulares(Cadherina-E); su frecuencia y aumento del riesgo para el cáncer de mama aún no se conoce con exactitud. En más del 50 % de los casos se desconoce el gen asociado al cáncer de mama heredado.[30] En comparación con países con población totalmente caucásica, la prevalencia de estas mutaciones en la población de América Latina es posiblemente menor.[30]
A través de la secuenciación de 560 genomas de pacientes con cáncer de mama, se identificaron cinco nuevos genes cancerígenos (MED23, FOXP1, MLLT4, XBP1 y ZFP36L1) para los cuales la evidencia era previamente ausente o equívoca, o para los cuales las mutaciones indican que el gen actúa en el cáncer de mama de una manera recesiva en lugar de dominante.[33]
Hormonas
editarLos estrógenos exógenos, en especial los utilizados en la terapia de sustitución hormonal junto a la predisposición genética, constituyen los elementos de mayor peso en la aparición del cáncer de mama.[34] Muchas mujeres toman este tipo de terapia para reducir los síntomas de la menopausia. También se ha descrito un ligero aumento del riesgo de cáncer de mama en las mujeres que toman anticonceptivos orales.[35]
Entre los factores asociados a hormonas femeninas y una mayor frecuencia de cáncer de mama se incluyen la precocidad en la madurez sexual (antes de los 12 años), la menopausia después de los 50 años, la nuliparidad y el primer embarazo a término logrado después de los 30 o 35 años.[36] [37] Por otro lado, si la primera menstruación ocurre después de los 12 años, la menopausia es antes de los 50 años, o el primer embarazo ocurre antes de los 10-20 años que sigue a la primera menstruación, el riesgo de cáncer de mama es menor.[38]
Existen conclusiones definitivas sobre una asociación entre el aborto practicado en el primer trimestre de la gestación y el riesgo posterior de cáncer de mama.[39]
Estudios epidemiológicos han sugerido que una dieta con alto contenido de fitoestrógenos, que son compuestos polifenólicos similares al estradiol y presentes en plantas tales como soya, cereales y otros 300 vegetales y legumbres, puede estar asociada con baja incidencia de cáncer de mama, sin embargo los estudios científicos siguen arrojando conlusiones contradictoras.[40]
Permeabilidad intestinal aumentada
editarRecientes descubrimientos han demostrado la asociación entre el cáncer de mama y un exceso de producción de zonulina en el intestino.[3]
La función principal de la zonulina es regular el flujo de moléculas entre el intestino y el torrente sanguíneo, aflojando las uniones estrechas intercelulares (los "poros" del intestino) para permitir el paso de nutrientes y bloquear el paso de macromoléculas, fragmentos de nutrientes incompletamente digeridos, toxinas y microorganismos del intestino proximal.[42]
Cuando hay una sobreproducción de zonulina, se abren en exceso las uniones estrechas de la pared intestinal (aumenta la permeabilidad intestinal), el intestino pierde su capacidad de barrera protectora y pasan al torrente sanguíneo sustancias que no deberían pasar. Esto puede ocasionar, tanto en el intestino como en otros órganos y en función de la predisposición genética de cada persona, el desarrollo de cánceres, enfermedades autoinmunes e inflamatorias.[4] En la mayoría de los casos, el aumento de la permeabilidad intestinal aparece antes que la enfermedad y desencadena el proceso multiorgánico que provoca el desarrollo de enfermedades sistémicas, como el cáncer.[4]
Los dos factores más potentes que provocan la liberación de zonulina y el consiguiente aumento de la permeabilidad intestinal son ciertas bacterias intestinales y la gliadina (principal fracción tóxica del gluten),[4] independientemente de la predisposición genética, es decir, tanto en celíacos como en no celíacos.[41][43] Otras posibles causas son la prematuridad, la exposición a la radiación y la quimioterapia.[4]
El descubrimiento del papel de la permeabilidad intestinal en el desarrollo de estas enfermedades desbarata las teorías tradicionales y sugiere que estos procesos pueden ser detenidos si se impide la interacción entre los genes y los factores ambientales desencadenantes, a través del restablecimiento de la función de la barrera intestinal dependiente de la zonulina.[4]
Otros
editarSegún un investigador llamado Kelly donde publicó en la revista Science explica que en general las mujeres de raza blanca tienen mayor probabilidad de tener cáncer de seno.[44] Sin embargo, aunque existe el riesgo de perder la capacidad de tener hijos (debido fundamentalmente a que la quimio y radioterapia pueden destruir los tejidos reproductores), existen en la actualidad diferentes medios de preservación de fertilidad, que están disponibles en los centros sanitarios para prevenir este problema.
Se ha sugerido que la contaminación ambiental, los productos químicos de los desodorantes, los sostenes tipo aro con varillas y los implantes de mama aumentan el riesgo de padecer cáncer de mama, sin embargo, no existe aún base científica para confirmar que estos factores aumenten el riesgo.[45]
Las mujeres que tomaron dietilestilbestrol (DES) para evitar abortos pueden tener un mayor riesgo de sufrir cáncer de mama después de los 40 años.[46] Esta droga se le suministraba a las mujeres entre los años 1940 y 1960.
La obesidad ha estado asociada con el cáncer de mama,[46] aunque este vínculo es controvertido. La teoría es que las mujeres obesas producen más estrógeno, el cual puede estimular el desarrollo de este cáncer.
Si un paciente recibió radioterapia cuando era niño o adulto joven para tratar un cáncer del área del tórax,[46] existe un riesgo mayor de que padezca cáncer de mama. Cuanto más joven haya sido al iniciar la radiación, mayor será el riesgo, especialmente si la radioterapia se administró cuando a la mujer se le estaban desarrollando las mamas.
Se discute la influencia del licor sobre el riesgo de cáncer de mama.[46] Debe sin embargo hacerse énfasis que mujeres que no tienen ningún factor de riesgo conocido pueden desarrollar cáncer de mama, por lo que la ausencia de factores de riesgo no debe causar una falsa sensación de seguridad.
También se ha asociado a la enfermedad periodontal con un mayor riesgo de cáncer de mama posmenopáusico, en particular entre las ex-fumadoras que dejan de fumar en los últimos 20 años.[47]
La nuliparidad permanente o a largo plazo son factores de riesgo para el cáncer de mama. Por ejemplo, un metaanálisis de 8 estudios basados en la población en los países nórdicos encontró que nunca llegar a dar a luz está asociado con un aumento del 30% en el riesgo de padecer cáncer de mama, en comparación con las mujeres que han dado a luz; además, el riesgo se va reduciendo en aproximadamente un 16% por cada 2 partos llevados a cabo. Las mujeres que tuvieron su primer parto después de los 35 años presentaron un riesgo un 40% mayor en comparación con las que tuvieron su primer parto antes de los 20 años.[48] Amamantar, por otro lado, es un factor que reduce el riesgo en el cáncer de mama sin receptores de estrógeno (ER-).[49]
Cuadro clínico
editarEl principal motivo de consulta en relación con las mamas de una mujer es la detección de una masa o tumoración. Aproximadamente el 90 % de todas las masas mamarias son causadas por lesiones benignas. Las que son suaves y masas elásticas se asocian generalmente con un fibroadenoma en mujeres de 20 a 30 años de edad y quistes en las mujeres entre 30 y 40 años.[50][51] Las masas malignas de mama se caracterizan por ser solitarias, no muy notorias, duras y dolorosas a la palpación.
Otra manifestación frecuente es dolor en los senos. Dicha mastalgia rara vez se asocia con cáncer de mama y suele estar relacionada con cambios fibroquísticos en las mujeres premenopáusicas.[52] Las mujeres posmenopáusicas que reciben terapia de reemplazo de estrógeno también pueden quejarse de dolor en los senos provocado por cambios fibroquísticos.[53] El dolor de estos trastornos fibroquísticos suele verse acompañado de pequeñas tumoraciones difusas en las mamas.
El cáncer de mama precoz generalmente no causa síntomas; razón por la cual los exámenes regulares de las mamas son importantes. A medida que el cáncer crece, los síntomas pueden incluir enrojecimiento, hinchazón y retracción de la piel o del pezón con la aparición de agujeros o fruncimiento que luce como cáscara de naranja. Otro problema frecuente es la secreción del pezón. El flujo de un carcinoma de mama suele ser espontáneo, con sangre, asociado a una masa y localizado en un solo conducto en uno de las mamas. En algunos casos la secreción de líquido proveniente del pezón puede ser de color claro a amarillento o verdoso, y lucir como pus.
Tumores mamarios o tumoraciones en las axilas que son duras, tienen bordes irregulares y generalmente no duelen. Cambio en el tamaño, forma o textura de las mamas o el pezón. Los hombres también pueden desarrollar cáncer de mama y los síntomas abarcan tumoración mamaria, así como dolor y sensibilidad en las mamas.
Los síntomas del cáncer de mama avanzado pueden abarcar:
- Bulto en el pecho
- Aumento del tamaño de los ganglios linfáticos (adenopatías) en la axila
- Cambios en el tamaño, textura de la piel o color de la mama
- Enrojecimiento de la piel
- Formación de depresiones o arrugas
- Cambios o secreción por el pezón
- Descamación
- Tracción del pezón hacia un lado o cambio de dirección
- Dolor óseo.
- Dolor o molestia en las mamas.
- Úlceras cutáneas.
- Hinchazón de un brazo (próximo a la mama con cáncer).
- Pérdida de peso.
Hay que enfatizar que el cáncer de mama puede manifestarse como una tumoración asintomática y que cuando ya hay retracción de la piel sea un cáncer avanzado, por lo que al detectar una masa, la paciente debe buscar ayuda profesional y pedir un diagnóstico exacto basado en estudios y no en presunción clínica.
Diagnóstico
editarEl examen de seno se debe realizar en posición vertical, sentada y acostada con las manos de la mujer detrás de la cabeza. Los senos deben ser inspeccionados en busca de diferencias en el tamaño, retracción de la piel o del pezón, patrones venosos prominentes y signos de inflamación. Se debe usar la superficie plana de la punta de los dedos para palpar el tejido mamario contra la pared torácica. Las zonas axilares y supraclaviculares deben ser revisadas en busca de nódulos. El pezón debe comprimirse suavemente para comprobar si hay secreciones.
Mamografía
editarLa extensión del uso de la mamografía ha sido eficaz, ya que ha reducido la tasa de mortalidad del cáncer de mama hasta un 30 %.[54] La mamografía es el mejor método de cribado de lesiones tempranas disponible. La tasa de supervivencia para las mujeres con cáncer de mama se incrementa drásticamente cuando se diagnostica en una etapa temprana, detectado precozmente tiene una sobrevida a los 10 años que alcanza hasta un 98 %.[55] Desafortunadamente, solo el 60 % de los cánceres se diagnostican en una fase localizada. De manera que la mamografía regular debe ir acompañada de un examen físico regular de mama para mejorar ese porcentaje.
Se recomienda la mamografía cada año para las mujeres asintomáticas mayores de 40 años.[56] Se le conoce como mamografía de detección, despistaje o «screening» y utiliza un protocolo de dos proyecciones, por lo general una de ellas en dirección oblicua lateral medial y la proyección craneocaudal, es decir, de arriba abajo.[57] La mamografía en mujeres sintomáticas o en aquellas con factores de riesgo elevados se le conoce como mamografía de diagnóstico y por lo general utilizan más de dos proyecciones por imagen.[57]
El pesquistaje en mujeres de 50 a 75 años de edad disminuye significativamente la tasa de mortalidad por cáncer de mama. El cribado en mujeres entre 40 y 49 años es controvertido, debido a una menor incidencia de la enfermedad en este grupo de edad y a que las mamas son más densas lo cual disminuye la sensibilidad de la mamografía. Varios estudios muestran una reducción significativa en las tasas de mortalidad en mujeres de esta franja de edad que recibieron mamografías, mientras que otros trabajos no demostraron beneficios en este grupo.[55] En los casos de personas con mamas densas lo importante es realizar pruebas complementarias para descartar falsos negativos: test de Octava Pink, ecografía y/o Resonancia magnética.
Existe la posibilidad de obtener falsos positivos con las mamografías. Las mujeres en edades comprendidas entre 40 y 69 años tienen una probabilidad del 30 % de falsos positivos en su mamografía durante un periodo de 10 años. Estos falsos positivos conllevan a exámenes complementarios, seguimiento y biopsias, aumento de los costos e innecesaria ansiedad, cuyas consecuencias psicológicas pueden persistir incluso después de un resultado final benigno.[cita requerida] La frecuencia de falsos positivos es mayor para las mujeres más jóvenes debido a que la mayoría de las masas en sus senos suelen ser benignos.[55]
Ecografía
editarEl pesquisaje por ultrasonido es útil para diferenciar entre masas o tumores mamarios sólidos y los quísticos, fundamentalmente cuando una masa palpable no es bien visualizado en una mamografía.[58] La ecografía es especialmente útil en mujeres jóvenes con tejido mamario denso con una masa palpable que no se visualiza en una mamografía. La ecografía no debe ser utilizada en los controles de rutina, sobre todo porque no se visualizan las microcalcificaciones y la detección de carcinomas es insignificante con la ecografía.[59]
Octava Pink
editarSe trata de un método en el que se hace el diagnóstico de cáncer de mama mediante un análisis de sangre en el que se detectan los anticuerpos compatibles con el desarrollo de un cáncer de mama. Es una prueba no invasiva (un análisis de sangre) en la que se separa el suero de la sangre. Una vez separado el suero se analizan los anticuerpos encontrados en el suero.
Los procesos inmunológicos que provocan la producción de autoanticuerpos se deben a la presencia de proteínas alteradas en las células cancerosas y que provocan una respuesta inmune. Las alteraciones se deben a mutaciones, degradación inadecuada, sobreexpresión y/o la liberación de proteínas del tejido dañado. Esta técnica es en la que se basa Octava Pink como parte de un uso clínico rutinario y no presenta riesgos para la paciente, siendo únicamente necesaria la toma de una muestra de sangre periférica.
En un ensayo realizado muy recientemente, se usaron 1009 muestras de suero (397 de mujeres con cáncer de mama y 612 de mujeres sanas). 721 muestras fueron utilizadas para ajustar la prueba, y las 288 se usaron para comprobar la fiabilidad de la prueba. OctavaPink reconoció como enfermas a 81 de las 120 muestras procedentes de mujeres con cáncer de mama, y como sanas a 165 de las 168 muestras. Estos datos proporcionan una sensibilidad del 68 % y una especificidad del 98 %.
Esta prueba es recomendable en grupos de personas de riesgo: Personas que tengan mamas densas, personas de alto riesgo de cáncer familiar o que hayan dado positivo en una mutación patógena en un gen BRCA, personas que no pueden realizarse una mamografía.
Esta prueba está contraindicada en personas que hayan tenido tratamientos con cualquier tipo de inmunosupresores, estén en tratamiento oncológico o hayan sido diagnósticados alguna vez de cáncer de mama, pues son todas situaciones en las que los niveles de anticuerpos pueden estar alterados fuera de lo normal por lo que el resultado de la prueba puede ser incorrecto.
Resonancia magnética de alto campo
editarLa resonancia magnética de alto campo es un método adicional y complementario para detectar y diagnósticar el cáncer de mama y se debe usar en mujeres de alto riesgo, se puede utilizar para detectar o confirmar la presencia del cáncer y evaluar su extensión. Al igual que otras pruebas se debe usar en personas con alto riesgo de cáncer de mama familiar. Si bien no es una herramienta habitual en el cribado por su alto coste y porque genera muchos falsos positivos, pero si es de uso habitual en mujeres que ya han sido diagnosticadas.
The Blue Box
editarThe Blue Box es un dispositivo capaz de detectar biomarcadores del cáncer de mama realizando un análisis químico de una muestra de orina y enviando el resultado a la nube donde se ejecuta un algoritmo basado en la inteligencia artificial (IA), que elabora un diagnóstico susceptible de ser consultado en tiempo real y almacenado mediante una aplicación móvil.
El dispositivo ha sido desarrollado por Judit Giró, una ingeniera bioquímica española, mediante dos prototipos, el primero realizado en colaboración con el Hospital Universitari Sant Joan de Reus y el segundo en la Universidad de California en Irvine, que tiene una tasa de clasificación del 95% e incorpora la inteligencia artificial (IA) y sobre el que continúa investigando para en un futuro alcanzar la etapa de ensayos clínicos y continuar entrenándolo con el objetivo de detectar el cáncer en estados tempranos.[60][61]
Tratamiento
editarEl tratamiento del cáncer de mama depende del estado del cáncer y de la edad de la persona, y puede incluir:[62][63]
- Cirugía. Hay varios procedimientos quirúrgicos dependiendo del tamaño tumoral y del compromiso ganglionar.
- Tumorectomía o lumpectomía: consiste en la extirpación de la masa tumoral con un margen de tejido adecuado.
- Cuadrantectomía: implica la extirpación de un cuadrante mamario con el tumor; puede acompañarse o no de vaciamiento ganglionar, es decir, de la extirpación de los ganglios linfáticos axilares.
- Mastectomía simple: consiste en la extirpación de la mama con el tumor, incluyendo el pezón, areola y piel, así como uno o más ganglios linfáticos axilares. No se remueve ninguno de los músculos por debajo del pecho. Puede ser higiénica en tumores avanzados, con fines paliativos.
- Mastectomía radical modificada: se hace resección de la mama con vaciamiento axilar. Se deja un sistema de drenaje a presión negativa.
- Medicamentos o quimioterapia por vía intravenosa u oral o quimioterapia por vía intratecal (medicamentos introducidos en la médula espinal con una aguja, en el área denominada espacio subaracnoide)[64]
- Radioterapia
- Terapia biológica
- Terapia adyuvante
- Hormonoterapia Se utiliza un antagonista de los estrógenos como el Tamoxifén.
- Medicamentos para prevenir y tratar náuseas y otros efectos secundarios del tratamiento.
- Psicoterapia
Pronóstico
editarLa supervivencia global a los cinco años fue de 59,9 %. Se halló que las mujeres con estadio clínico I presentaron la mayor supervivencia (82 %), seguidas por aquellas con estadios IIB (70,4 %), IIA (65,3 %), IIIB (47,5 %), IIIA (44,2 %) y al final aquellas con estadio IV (15 %)[12] El efecto de mayor infiltración metastásica fue notorio en las mujeres con metástasis hematógenas, quienes mostraron la menor supervivencia (21,4 %).[12] Las mujeres que recibieron quimioterapia y radioterapia tuvieron la menor supervivencia (52 %) aunque esta diferencia no fue significativa. En las mujeres que no tuvieron persistencia del cáncer de mama, la supervivencia fue de 72,3 %, a diferencia de aquellas que sí la presentaron, en las cuales se identificó una supervivencia de 12,6 %.[12]
Por las diferentes campañas de divulgación pública, en Estados Unidos, la mayoría de las mujeres saben que las enfermedades cardiovasculares constituyen la principal causa de muerte. Sin embargo, el problema que más temen es el cáncer de mama, a pesar de que el decenio de 1990 han disminuido las tasas de muerte por esa neoplasia. Aunque muchas mujeres ancianas adquieren cáncer de mama, fallecen por otras causas. Solo una minoría de las mujeres saben que el cáncer de pulmón es la causa principal de muerte por neoplasia en mujeres. Tales conceptos erróneos constituyen un elemento desafortunado porque perpetúan la escasa atención que se presta a factores modificables de riesgo como la dislipidemia, hipertensión o tabaquismo.[65]
Metástasis y cambios genómicos
editarSe ha observado en estudios de comparación genómica pan-cáncer entre tumores primarios y metastásicos que aparece variabilidad en la evolución genómica del cáncer de mama durante la metástasis, lo que sugiere una complejidad en su progresión y resistencia a tratamientos.[66] Los estudios han identificado alteraciones genéticas adicionales en el cáncer de mama metastático, incluyendo mutaciones en genes como ESR1 y amplificaciones de AR, asociadas con resistencia a terapias hormonales. Esto puede tener implicaciones significativas en el desarrollo de terapias más efectivas.
Impacto social
editar«Las representaciones sociales de una enfermedad son determinantes de los comportamientos culturales con respecto a la misma, en las cuales confluyen un complejo conjunto de conocimientos científicos y populares, la escala de valores y otros elementos culturales, como las creencias, que determinan la reacción general de la sociedad y la particular de cada individuo frente a una enfermedad».[67] Debido al ambiente social en que se desarrolla el hombre, quizás se pueda afirmar que ninguna enfermedad es meramente biológica ni meramente social. Pero debido al órgano en particular que es afectado por esta enfermedad, y además afectado en el tratamiento, el cáncer de mama es un ejemplo latente de cómo una enfermedad biológicamente menos agresiva e invasiva que muchas otras, se puede convertir en una de las más temidas.
La mama constituye un órgano de la estética femenina y es, además, una glándula sebácea modificada que interviene en la lactancia materna.[68] Por lo tanto, la mama no es un órgano más, sino que más que un órgano es parte de la identidad femenina; expresado de otra forma, al humanizarse, la mama se convierte en seno.[69] Para la mujer, sus mamas cumplen una función estética para sí misma antes que para los demás.[70] «Si la función única de la mama femenina fuera la lactancia como sucede en el resto de mamíferos sus enfermedades tendrían sin duda mucha menos trascendencia de la que tienen.»[70]
El cáncer de mama posee fuertes representaciones sociales ya que las mujeres temen el «abandono de la pareja, involucrando el mundo afectivo y sexual y deteriorando su autoestima, porque este cáncer compromete órganos que son, especialmente, erógenos y atractivos para ellas»,[67] a lo que se suma la desestabilización del proyecto de vida, lo que da lugar a un giro definitivo de las relaciones y del estilo de vida, y cambios drásticos en el mundo laboral y social.[67]
En Colombia se realizó un estudio en el que se expone que, frente al diagnóstico, las pacientes «expresan temor a ser juzgadas por no prevenir y a su vez, a recibir diagnóstico confirmatorio de la enfermedad (...). Adicionalmente, imaginan los procedimientos como dolorosos. En síntesis las representaciones del cáncer de mama en las mujeres del estudio, fueron bastante tenebrosas y denotaron enorme temor a la perdida, a la mutilación, al dolor y la muerte».[67]
Véase también
editarReferencias
editar- ↑ a b MedlinePlus (diciembre 2009). «Cáncer de mama». Enciclopedia médica en español. Consultado el 2 de junio de 2010.
- ↑ a b Instituto Nacional del Cáncer (marzo 2010). «Información general sobre el cáncer del seno (mama)». Consultado el 1 de junio de 2010.
- ↑ a b c Fasano, A (2012 Oct). «Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications». Clin Gastroenterol Hepatol 10 (10): 1096-100. PMC 3458511. PMID 22902773. doi:10.1016/j.cgh.2012.08.012.
- ↑ a b c d e f g h Fasano, A (2011 Jan). «Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer». Physiol Rev 91 (1): 151-75. PMID 21248165. doi:10.1152/physrev.00003.2008. Archivado desde el original el 26 de agosto de 2015.
- ↑ por RTVE.es. «Día mundial del Cáncer de Mama». Consultado el 19 de octubre de 2011.
- ↑ Palmero PJ; Lassard RJ; Juárez ALA; Medina NCA (19 de enero de 2021). «Cáncer de mama: una visión general». Acta médica grupo Ángeles 2021;19(3):354-360. ISSN 1870-7203. doi:10.35366/101727. Consultado el 20 de octubre de 2023.
- ↑ a b Greaves, Mel (2004). Cáncer, el legado evolutivo. Editorial Crítica. p. 24. ISBN 84-843-2362-5.
- ↑ a b c d e Junceda Avello, Enrique (1984). [http://books.google.com.ar/books?INFORMÁTICA id=hRVxLpoqDsUC&pg=PA13&dq=%22C%C3%A1ncer+de+mama%22+%22Antecedentes+historicos%22+%22papiro+egipcio+de+Edwin+Smith%22+%22papiro+de+Ebers%22+Hip%C3%B3crates+Galeno+%22Le%C3%B3nidas,+de+Alejandr%C3%ADa%22+%22Aecio,+de+Mesopotamia%22+%22Pablo+de+Egina%22&hl=es&sa=X&ei=FdJtVP78BMibNui7g7gP&ved=0CB0Q6AEwAA#v=onepage&q=%22C%C3%A1ncer%20de%20mama%22%20%22Antecedentes%20historicos%22%20%22papiro%20egipcio%20de%20Edwin%20Smith%22%20%22papiro%20de%20Ebers%22%20Hip%C3%B3crates%20Galeno%20%22Le%C3%B3nidas%2C%20de%20Alejandr%C3%ADa%22%20%22Aecio%2C%20de%20Mesopotamia%22%20%22Pablo%20de%20Egina%22&f=false Cáncer de mama]. España: Universidad de Oviedo. p. 13. ISBN 84-7468-137-5. Consultado el 20 de noviembre de 2014.
- ↑ a b c d Fernández-Cid Fenollera, Alfonso, y colaboradores (2000). Mastología (2ª edición). Barcelona: Masson S.A. p. 4. ISBN 84-458-0844-3. Consultado el 20 de noviembre de 2014.
- ↑ a b Junceda Avello, Enrique (1984). Cáncer de mama. España: Universidad de Oviedo. p. 15. ISBN 84-7468-137-5.
- ↑ McPherson K, Steel CM, Dixon JM. ABC of breast diseases. Breast cancer-epidemiology, risk factors, and genetics. Bmj 2000;321(7261):624-628.
- ↑ a b c d Flores-Luna, Lourdes; Salazar-Martínez, Eduardo; Duarte-Torres, Reyna Margarita; Torres-Mejía, Gabriela; Alonso-Ruiz, Patricia; Lazcano-Ponce, Eduardo (marzo/abril 2008). «Factores pronósticos relacionados con la supervivencia del cáncer de mama» [Prognostic factors related to breast cancer survival]. Salud pública de México 50 (2): 119-125. ISSN 0036-3634. Consultado el 14 de noviembre de 2012.
- ↑ a b PERALTA M, Octavio. Cáncer de Mama en Chile: Datos epidemiológicos-Se describen los análices epidemiológicos del cáncer de mama en Chile y se relata la experiencia en el Hospital Clínico San Borja-Arriarán, destacando la mayor precocidad en el diagnóstico (en español). Rev. chil. obstet. ginecol. [online]. 2002, vol.67, n.6 [citado 2010-06-01], pp. 439-445. ISSN 0717-7526. doi: 10.4067/S0717-75262002000600002.
- ↑ a b c d ROBLES, Sylvia C. and GALANIS, Eleni. «El cáncer de mama en América Latina y el Caribe.» Rev Panam Salud Publica [online]. 2002, vol.12, n.2 [cited 2010-06-03], pp. 141-143. ISSN 1020-4989. doi: 10.1590/S1020-49892002000800016.
- ↑ a b c d e Frecuencia del cáncer de mama, expresada como casos por 100 000 habitantes por año.
Referencia: GLOBOCAN 2008 (IARC) Section of Cancer Information (en inglés). Último acceso 3 de junio de 2010. - ↑ a b INCIDENCIA Y MORTALIDAD DEL CÁNCER EN COSTA RICA 1990-2003
- ↑ ALCARAZ, M. et al. Estudio de la no participación en el programa de prevención de cáncer de mama en la ciudad de Valencia (en español). Gac Sanit [online]. 2002, vol.16, n.3 [citado 2010-06-03], pp. 230-235. ISSN 0213-9111.
- ↑ KNAUL, Felicia Marie et al. Cáncer de mama en México: una prioridad apremiante (en español). Salud pública Méx [online]. 2009, vol.51, suppl.2 [cited 2010-06-03], pp. s335-s344. ISSN 0036-3634. doi: 10.1590/S0036-36342009000800026.
- ↑ a b MORALES, Luisa, REIGOSA, Aldo, CALEIRAS, Eduardo et al. Expresión del HER2/neu en pacientes venezolanas con cáncer de mama localmente avanzado (en español). Invest. clín. [online]. mar. 2008, vol.49, no.1 [citado 03 Junio 2010], p.69-78. ISSN 0535-5133.
- ↑ Martín Jiménez, M. Cáncer de mama. Arán Ediciones. pp. 35-43. ISBN 8496881067.
- ↑ Pathology and genetics of tumours of the breast and female genital organs, IARC, seventh edition
- ↑ a b c CABRERA MORALES, C. M.. Estudio comparativo de la amplificación de Her2/neu mediante FISH y PCR cuantitativa en tiempo real en tumores de mama (en español). Oncología (Barc.) [online]. 2005, vol.28, n.10 [citado 2010-06-05], pp. 26-30. ISSN 0378-4835. doi: 10.4321/S0378-48352005001000003.
- ↑ Livasy CA, Karaca G, Nanda R, et al. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol 2006; 19: 264–271
- ↑ http://www.conganat.org/10congreso/trabajo.asp?id_trabajo=1984&tipo=1#Nuevos marcadores moleculares predictivos y de respuesta en el tratamiento del cáncer de mama: perfiles de expresión génica.
- ↑ Massagué J. «Sorting Out Breast-Cancer Gene Signatures.» N Engl J Med 2007; 356;3: 294-297.
- ↑ a b LUGONES BOTELL, Miguel y RAMIREZ BERMUDEZ, Marieta. Aspectos históricos y culturales sobre el cáncer de mama (en español). Rev Cubana Med Gen Integr [online]. 2009, vol.25, n.3 [citado 2010-06-03]. ISSN 0864-2125.
- ↑ Benjamin S, Lee A, Saunders W (1999). «Classification and behavior of canine mammary epithelial neoplasms based on life-span observations in beagles». Vet Pathol 36 (5): 423-36. PMID 10490210. doi:10.1354/vp.36-5-423.
- ↑ M. J. Tomlinson, L. Barteaux, L. E. Ferns, and E. Angelopoulos. «Feline Mammary Carcinoma: A Retrospective Evaluation of 17 Cases.» (en inglés). Can Vet J. 1984 December; 25(12): 435-439. PMCID: PMC1790684
- ↑ CDCespanol (2 de agosto de 2023). «¿Cuáles son los factores de riesgo del cáncer de mama?». Centers for Disease Control and Prevention. Consultado el 13 de febrero de 2024.
- ↑ a b c Figueroa G, Luis; Bargallo R, Enrique; Castorena R, Gerardo y Valanci A, Sofía. Cáncer de mama familiar, BRCA1 positivo (en español). Rev Chil Cir [online]. 2009, vol.61, n.6 [citado 2010-06-06], pp. 547-551. ISSN 0718-4026. doi: 10.4067/S0718-40262009000600010.
- ↑ Página de JAMA para el Paciente. Genética y cáncer de mama (en español). Último acceso 7 de junio de 2010.
- ↑ doi:10.1038/nature11143
- ↑ Nik-Zainal, Serena; Davies, Helen; Staaf, Johan; Ramakrishna, Manasa; Glodzik, Dominik; Zou, Xueqing; Martincorena, Inigo; Alexandrov, Ludmil B. et al.. «Landscape of somatic mutations in 560 breast cancer whole-genome sequences». Nature 534 (7605): 47-54. PMC 4910866. PMID 27135926. doi:10.1038/nature17676.
- ↑ COPPOLA, Francisco, NADER, José y AGUIRRE, Rafael. «Metabolismo de los estrógenos endógenos y cáncer de mama.» Archivado el 9 de marzo de 2016 en Wayback Machine. Rev. Méd. Urug. [online]. mar. 2005, vol.21, no.1 [citado 05 Junio 2010], p.15-22. ISSN 0303-3295.
- ↑ «Los anticonceptivos orales y el riesgo de cáncer de mama.» Rev Panam Salud Publica [online]. 2002, vol.12, n.2 [cited 2010-06-05], pp. 125-126. ISSN 1020-4989. doi: 10.1590/S1020-49892002000800010.
- ↑ Centros para el Control y la Prevención de Enfermedades Cáncer de mama: Factores de riesgo (en español).
- ↑ Tejerina, Florencio (1992). Cirugía del cáncer de mama. Ediciones Díaz de Santos. p. 124. ISBN 8479780576.
- ↑ Shigyo G, Del Alcazar J, Portugal W, Campana L. «Factores asociados en el cáncer de mama. Hospital Guillermo Almenara en Lima, Perú, 1941-1990.» Revista Peruana de Epidemología - Vol. 5 Nº 2 Noviembre 1992. Último acceso 6 de junio de 2010.
- ↑ «El aborto inducido y el riesgo de cáncer de mama: ¿existe una relación?» Rev Panam Salud Publica [online]. 2000, vol.7, n.6 [cited 2010-06-06], pp. 403-403. ISSN 1020-4989. doi: 10.1590/S1020-49892000000600008.
- ↑ BERMUDEZ-PIRELA, V, BERMUDEZ-ARIAS, F, LEAL-GONZALEZ, E et al. «Quimioprevención del cáncer de mama: fronteras y horizontes.» AVFT. [online]. 2005, vol.24, no.1 [citado 06 Junio 2010], p.32-41. ISSN 0798-0264.
- ↑ a b Hollon, J; Puppa, EL; Greenwald, B; Goldberg, E; Guerrerio, A; Fasano, A (2015 Feb 27). «Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with non-celiac gluten sensitivity». Nutrients 7 (3): 1565-76. PMID 25734566. doi:10.3390/nu7031565.
- ↑ Fasano, A (2009). «Conocimiento del diálogo de interacción entre el microbio y el hospedador». Ann Nestlé 67 (1): 9–18. doi:10.1159/000225912.
- ↑ Fasano, A (2012 Oct). «Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications». Clin Gastroenterol Hepatol 10 (10): 1096-100. PMC 3458511. PMID 22902773. doi:10.1016/j.cgh.2012.08.012.
- ↑ Servick, K. (2014) «Breast Cancer: A world of Differences.» Science, 1452
- ↑ Martin-Zurro, Amando (2003). Atención primaria. Elsevier España. p. 1100. ISBN 8481746509.
- ↑ a b c d Taylor, Robert B. (2003). Medicina de familia: principios y práctica (6ta edición). Elsevier España. p. 993. ISBN 844581298X.
- ↑ Freudenheim JL et al. Periodontal Disease and Breast Cancer: Prospective Cohort Study of Postmenopausal Women. Cancer Epidemiol Biomarkers Prev. 2015; 1–8.
- ↑ «Age at first birth, parity and risk of breast cancer: A meta-analysis of 8 studies from the Nordic countries». International Journal of Cancer 46 (4): 597-603. 1990. PMID 2145231. doi:10.1002/ijc.2910460408.
- ↑ Fortner, Renée T.; Sisti, Julia; Chai, Boyang; Collins, Laura C.; Rosner, Bernard; Hankinson, Susan E.; Tamimi, Rulla M.; Eliassen, A. Heather (2019-12). «Parity, breastfeeding, and breast cancer risk by hormone receptor status and molecular phenotype: results from the Nurses’ Health Studies». Breast Cancer Research (en inglés) 21 (1): 40. ISSN 1465-542X. PMC 6416887. PMID 30867002. doi:10.1186/s13058-019-1119-y. Consultado el 22 de julio de 2021.
- ↑ por MedlinePlus (diciembre 2009). «Fibroadenoma de mama». Enciclopedia médica en español. Consultado el 8 de junio de 2010.
- ↑ por MedlinePlus (agosto 2009). «Tumor mamario». Enciclopedia médica en español. Consultado el 8 de junio de 2010.
- ↑ por MedlinePlus (diciembre 2009). «Enfermedad fibroquística de las mamas». Enciclopedia médica en español. Consultado el 8 de junio de 2010.
- ↑ por MedlinePlus (agosto 2009). «Hormonoterapia». Enciclopedia médica en español. Consultado el 8 de junio de 2010.
- ↑ Smith, Roger P. (2004). Netter obstetricia, ginecología y salud de la mujer. Elsevier, España. p. 327. ISBN 8445813110.
- ↑ a b c UCHIDA S, Marcela. Mamografía de Screening y Realidad Chilena (en español). Rev. chil. radiol. [online]. 2008, vol.14, n.3 [citado 2010-06-10], pp. 130-134. ISSN 0717-9308. doi: 10.4067/S0717-93082008000300005.
- ↑ Ikeda, Debra (2005). Radiología de mama. Elsevier, España. p. 2. ISBN 8481748617.
- ↑ a b Bushong, Stewart C. (2005). Manual de radiología para técnicos: Física, Biología y protección radiológica (8va edición). Elsevier, España. p. 324. ISBN 8481748641.
- ↑ Winchester, David J. (2001). Cáncer de mama. Elsevier, España. p. 44. ISBN 8481745367.
- ↑ Newman, L.A. Clínicas Quirúrgicas de Norteamérica 2007. Volumen 87 no 2: Cáncer de mama. Elsevier, España. p. 473. ISBN 8445818317.
- ↑ «Blue Box, el invento español que detecta el cáncer de mama por la orina». SESPM. 6 de diciembre de 2020. Consultado el 2 de junio de 2021.
- ↑ «The Blue Box, un dispositivo para detectar el cáncer de mama desde casa». Blog de Lenovo. 23 de febrero de 2021. Consultado el 2 de junio de 2021.
- ↑ ref name=E>Maite Hernández Menéndez, María de los Ángeles Ríos Hernández: «Oncogenes y cáncer.» Archivado el 23 de septiembre de 2013 en Wayback Machine. Instituto Nacional de Oncología y Radiobiología. Rev Cubana Oncol 1999;15(2):131-9
- ↑ Walbaum, Benjamín; Rodríguez, Javier; Acevedo, Francisco; Camus, Mauricio; Manzor, Manuel; Martinez, Raúl; Veglia, Paulina; Murature, Geraldine et al. (1 de mayo de 2023). «Tratamiento sistémico actual para cáncer de mama avanzado hormono-dependiente». Revista Médica Clínica Las Condes. TEMA CENTRAL: FACETAS DE LA MEDICINA 34 (3): 224-234. ISSN 0716-8640. doi:10.1016/j.rmclc.2023.03.011. Consultado el 5 de junio de 2023.
- ↑ «Agentes citostáticos.» Archivado el 16 de mayo de 2013 en Wayback Machine. Protocolos de vigilancia sanitaria específica. Comisión de Salud Pública de Consejo Interterritorial del Sistema Nacional de Salud, España, 2003.
- ↑ Andrea Dunaif (2009) [1958]. «Capítulo 6: Salud de la mujer» (HTML). Escrito en Estados Unidos. En Anthony S. Fauci; Eugene Braunwald; Dennis L. Kasper et al., eds. Harrison: Principios de Medicina Interna 1 (17a edición). México: Mc-Graw Hill. pp. 39-44. ISBN 978-970-10-6788-8. OCLC 316604658. Edición original inglesa ISBN 978-0-07-147691-1. Consultado el 12-Mar-2012. (requiere suscripción). «Requiere suscripcion.»
- ↑ Martínez-Jiménez, Francisco; Movasati, Ali; Brunner, Sascha Remy; Nguyen, Luan; Priestley, Peter; Cuppen, Edwin; Van Hoeck, Arne (2023-06). «Pan-cancer whole-genome comparison of primary and metastatic solid tumours». Nature (en inglés) 618 (7964): 333-341. ISSN 1476-4687. PMC 10247378. PMID 37165194. doi:10.1038/s41586-023-06054-z. Consultado el 5 de enero de 2024.
- ↑ a b c d Giraldo-Mora, Clara V. (2009). «Persistencia de las representaciones sociales del cáncer de mama.». Revista de Salud Pública 11 (4): 514-525. ISSN 0124-0064. Consultado el 2 de marzo de 2015.
- ↑ Pérez Hechavarría, Gipsy de los Ángeles; Álvarez Cortés, Julia Tamara; Selva Capdesuñer, Ana; Guilarte Selva, Osiris Taimy; Pérez Hechavarría, Alejandro Roberto (2011). «Actividades educativas en mujeres con factores de riesgo de cáncer de mama». MEDISAN 15 (6): 754-761. ISSN 1029-3019. Consultado el 2 de marzo de 2015.
- ↑ Martínez Muñoz, Lidiana; Cruz Sánchez, Leticia; López Menes, Marta; Cruz Almaguer, Cecilia; Muiño López, María Cristina (2012). «Valoración del conocimiento del autoexamen de mama en mujeres en edad reproductiva del Policlínico Bernardo Posse». Revista Habanera de Ciencias Médicas 11 (3): 361-368. ISSN 1729-519X. Consultado el 2 de marzo de 2015.
- ↑ a b Sardiñas Ponce, Raysy (2009). «Autoexamen de mama: un importante instrumento de prevención del cáncer de mama en atención primaria de salud». Revista Habanera de Ciencias Médicas 8 (3). ISSN 1729-519X. Consultado el 2 de marzo de 2015.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Cáncer de mama.
- En MedlinePlus hay más información sobre Cáncer de mama
- The Cancer Genome Atlas Network, «Comprehensive molecular portraits of human breast tumours», Nature (septiembre de 2012).
- Vera Álvarez, Jesús Javier. «Factores Pronóstico del Cáncer de Mama». Boletín Oncológico, número 13. Hospital General de Teruel y Asociación Española contra el Cáncer. Consultado el 26 de octubre de 2014.