Tiobenzofenona
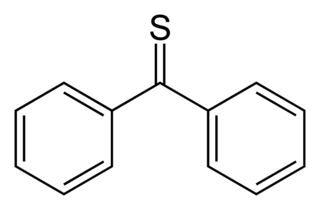
La tiobenzofenona es un compuesto organosulfurado con la fórmula (C6H5)2CS. Es la tiacetona prototípica. A diferencia de otras tiocetonas que tienden a dimerizarse para formar anillos y polímeros, la tiobenzofenona es bastante estable, aunque se fotooxida en el aire de nuevo a benzofenona y azufre.[2] La tiobenzofenona es de color azul intenso y se disuelve fácilmente en muchos disolventes orgánicos.
| Tiobenzofenona | ||
|---|---|---|
 | ||
 | ||
 | ||
| Nombre IUPAC | ||
| difenilmetanotiona | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | C13H18S | |
| Identificadores | ||
| Número CAS | 1450-31-3[1] | |
| ChemSpider | 502886 | |
| PubChem | 578536 | |
| UNII | JYQ6P4G3UJ | |
| Propiedades físicas | ||
| Apariencia | Sólido de color azul profundo. | |
| Olor | Azufre quemado totalmente | |
| Masa molar | 198,28 g/mol | |
| Punto de fusión | 53/54 °C (326/327 K) | |
| Punto de ebullición | 174 °C (447 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura
editarLa longitud del enlace C=S de la tiobenzofenona es de 1,63 Å, que es comparable a 1,64 Å, la longitud del enlace C=S del tioformaldehído, medida en fase gaseosa. Debido a interacciones estéricas, los grupos fenilo no son coplanares y el ángulo diédrico SC-CC es de 36°.[3]También se han preparado una variedad de tionas con estructuras y estabilidad relacionadas con la tiobenzofenona.[4]
Síntesis
editarUna de las primeras síntesis reportadas de tiobenzofenona implica la reacción de sulfhidrato de sodio y difenildiclorometano:[5]
Ph2CCl2 + 2 NaSH → Ph2C=S + 2 NaCl + H2S
Un método actualizado implica la sulfuración de benzofenona:[6]
Ph2C=O + H2S → Ph2C=S + H2O
En el esquema de reacción anterior, se pasa una mezcla de cloruro de hidrógeno gaseoso y sulfuro de hidrógeno a una solución enfriada de benzofenona en etanol. La tiobenzofenona también se puede producir mediante una reacción de Friedel-Crafts de cloruro de tiobenzoilo y benceno.[7]
Reactividad
editarDebido a la relativa debilidad del enlace C=S, la tiobenzofenona es más reactiva que la benzofenona. La tiobenzofenona (así como otras tiocetonas) es dipolarófila y dienófila. Por ejemplo, se combina con 1,3-dienos en cicloadiciones Diels-Alder.[8] La tasa de tiocetonas en las cicloadiciones está relacionada, entre otras, con el tamaño de la pequeña brecha de energía HOMO/LUMO de los π-MO del doble enlace C=S.[9]Las reacciones entre la tiobenzofenona y la mayoría de los dienos producen aductos de Diels-Alder, mientras que las reacciones con monoolefinas producen compuestos bicíclicos[10].
Referencias
editar- ↑ Número CAS
- ↑ «Metzner, Patrick (1999). "Thiocarbonyl Compounds as Specific Tools for Organic Synthesis". Organosulfur Chemistry I. Topics in Current Chemistry. Vol. 204. pp. 127–181».
- ↑ «Sustmann, R.; Sicking, W.; Huisgen, R. "A Computational Study of the Cycloaddition of Thiobenzophenone S-Methylide to Thiobenzophenone". J. Am. Chem. Soc. 2003, 125, 14425-14434».
- ↑ «Metzner, Patrick (1999). "Thiocarbonyl Compounds as Specific Tools for Organic Synthesis". Organosulfur Chemistry I. Topics in Current Chemistry. Vol. 204. pp. 127–181.».
- ↑ «H. Freudenberger "Thiobenzophenone" Organic Syntheses, 1931, Vol. 11, p.94.».
- ↑ «B. F. Gofton and E. A. Braude "Thiobenzophenone" Org. Synth. 1955, vol. 35, 97.».
- ↑ «Horst Viola, Steffen Scheithauer and Roland Mayer "Organische Schwefelverbindungen,97. Friedel-Crafts-Reaktionen mit Thiosäurechloriden" Chem. Ber. 1968, volume 101, pages 3517–3529.».
- ↑ «Fisera, Lubor; Huisgen, R.; Kalwinsch, Ivars; Langhals, Elke; Li, X.; Mloston, G.; Polborn, K.; Rapp, J.; Sicking, W.; Sustmann, R. (1996). "New Thione Chemistry". Pure and Applied Chemistry. 68 (4): 789–798.».
- ↑ «Sustmann, R.; Sicking, W.; Huisgen, R. "A Computational Study of the Cycloaddition of Thiobenzophenone S-Methylide to Thiobenzophenone". J. Am. Chem. Soc. 2003, 125, 14425-14434».
- ↑ «Okuma, Kentaro; Yamamoto, Toshiro; Shirokawa, Takafumi; Kitamura, Tsugio; Fujiwara, Yuzo (1996). "The First Isolation of Benzyne-Thiobenzophenone Adducts". Tetrahedron Letters. 37 (49): 8883–8886».