Terapia con células madre
La terapia con células madre es la utilización de células madre para el tratamiento o la prevención de una enfermedad o afección.[1]
Esta terapia se ha utilizado en trasplantes, tanto con células madre autólogas (del paciente) o con células alogénicas (de otro donante). Se estudian diversas fuentes de células madre además de la médula ósea.
Además está en fase de investigación para enfermedades neurodegenerativas y afecciones como la diabetes y las enfermedades cardíacas, entre otras.
La terapia con células madre es un tema controvertido debido a desarrollos tales como la capacidad para aislar y cultivar células madre embrionarias, para crear células madre utilizando la transferencia nuclear de células somáticas y su uso de técnicas para crear células madre pluripotentes inducidas. Ciertos desarrollos chocan con la política del aborto y con la clonación humana. Otro asunto controvertido es su comercio como la polémica que rodea el uso de bancos de sangre de cordón umbilical privados.
La FDA lanzó una ofensiva en 2018, contra clínicas que venden productos con células madre para medicina regenerativa, con indicaciones no aprobadas.[2]
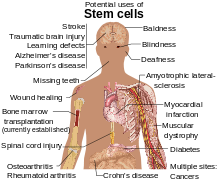
Usos médicos
editarLa médula ósea se usa para tratar afecciones como leucemias y linfomas, siendo su uso en terapia ampliamente usado.[3][4][5] Durante la quimioterapia, la mayoría de las células en crecimiento son eliminadas por los agentes citotóxicos. Sin embargo, estos agentes no pueden discriminar entre la leucemia o las células neoplásicas y las células madre hematopoyéticas sanas. Es este efecto secundario de las estrategias de quimioterapia convencionales que el trasplante de células madre intenta revertir; la médula ósea sana de un donante reintroduce células madre funcionales para reemplazar las células perdidas en el cuerpo del huésped durante el tratamiento. Las células trasplantadas también generan una respuesta inmune que ayuda a eliminar las células cancerosas (véase efecto injerto contra leucemia); sin embargo puede tener efectos adversos como la enfermedad injerto contra huésped, el efecto secundario más grave de este tratamiento.[6]
Para el tratamiento de la enfermedad aguda de injerto contra huésped en niños que no responden a los esteroides fue aprobada condicionalmente en Canadá en 2012 una terapia con células madre: el Prochymal.[7] Esta es una terapia celular alogénica basada en el uso de células madre mesenquimales (MSC) derivada de la médula ósea de donantes adultos. Estas células se purifican de la médula, se cultivan y se empaquetan, produciéndose hasta 10 000 dosis derivadas de un solo donante que se almacenan congeladas hasta que se necesiten.[8]
La FDA ha aprobado cinco productos hematopoyéticos de células madre derivados de la sangre del cordón umbilical, para el tratamiento de enfermedades sanguíneas y inmunológicas.[9]
En 2014, la Agencia Europea de Medicamentos recomendó la aprobación de células madre del limbo esclerocorneal para personas con deficiencia severa de células madre del limbo esclerocorneal debido a quemaduras en el ojo.[10]
Investigación
editarLas células madre están siendo estudiadas por múltiples razones. Las moléculas y los exosomas liberados por las células madre también se están estudiando para hacer medicamentos.[11] Se ha encontrado que los factores solubles paracrinos producidos por las células madre, conocidos como el secretoma de las células madre, son causantes que terapias basadas en células madre medien sus efectos en enfermedades degenerativas, autoinmunes e inflamatorias.[12]
Aplicaciones
editarNeurodegeneración
editarSe han realizado investigaciones sobre los efectos de las células madre en modelos animales con degeneración cerebral como la enfermedad de Parkinson, la esclerosis lateral amiotrófica, la enfermedad de Alzheimer,[13][14][15] También se han realizado estudios preliminares relacionados con la esclerosis múltiple.[16][17]
Los cerebros adultos sanos contienen células madre neurales que o se dividen para mantener el número general de células madre o se convierten en células progenitoras. En animales de laboratorio adultos sanos, las células progenitoras migran dentro del cerebro y principalmente mantienen las poblaciones de neuronas para el olfato. Se ha informado que la activación farmacológica de las células madre neurales endógenas estimula la neuroprotección y recuperación del comportamiento en modelos de ratas adultas de trastornos neurológicos.[18][19][20]
Lesión cerebral y medular
editarEl accidente cerebrovascular y la lesión cerebral traumática conducen a la muerte celular, caracterizada por la pérdida de neuronas y oligodendrocitos en el cerebro. Se investiga el uso de células madre en casos de lesiones de la médula espinal.[21][22][23]
Corazón
editarSe espera que el uso terapéutico de células madres beneficie a pacientes con cardiopatía grave.[24] Las investigaciones sobre estos tratamientos se retrasaron por el cardiólogo Bodo-Eckehard Strauer, que falseó sus datos, y fue desacreditado porque sus investigaciones tenían cientos de contradicciones objetivas.[25][26] Entre varios ensayos clínicos que informan que la terapia con células madre adultas es segura y eficaz, solo unos pocos estudios han reportado pruebas reales de beneficios.[27]
Algunos ensayos clínicos preliminares lograron solo mejoras modestas en la función cardíaca luego del uso de la terapia con células madre de la médula ósea..[28][29]
La terapia con células madre para el tratamiento del infarto de miocardio generalmente utiliza células madre autólogas de la médula ósea, pero se pueden usar otros tipos de células madre adultas, como las células madre derivadas del tejido adiposo.[30]
Los posibles mecanismos de recuperación incluyen:[14]
- Generación de células del músculo cardíaco.
- Estimular el crecimiento de nuevos vasos sanguíneos para repoblar el tejido cardíaco dañado
- Secreción de factores de crecimiento
En 2014, un metaanálisis sobre la terapia con células madre utilizando células madre de médula ósea para enfermedades del corazón reveló discrepancias en los informes de ensayos clínicos publicados, observándose que en los estudios con un mayor número de discrepancias mostraban un aumento en el tamaño del efecto.[31] Otro metanálisis basado en los datos de diseños experimentales intra-sujetos de 12 ensayos aleatorios no pudo encontrar ningún beneficio significativo de la terapia con células madre en los criterios de valoración clínicos primarios, como eventos adversos mayores o aumento en las medidas de la función cardíaca, concluyendo que no hubo beneficio.[32]
Un ensayo sobre el tiempo en la evaluación del infarto de miocardio (por cuestiones de mercadotecnia se pone el nombre de TIME trial), que utilizó un diseño de ensayo aleatorizado, doble ciego, controlado con placebo, concluyó que "la administración de células mononucleares de la médula ósea no mejoró la recuperación de la función del ventrículo izquierdo durante 2 años" en las personas que tuvieron un infarto de miocardio.[33] En consecuencia, un estudio controlado aleatorizado sobre la transferencia de médula ósea para mejorar la regeneración del infarto de elevación del ST (por motivos mercadotecnios BOOST-2 trial, llamándose con -2 para diferenciarse de un estudio anterior. Las siglas provienen de BOne marrOw transfer to enhance ST-elevation infarct regeneration) realizado en 10 centros médicos en Alemania y Noruega informó que el resultado del ensayo no apoya el uso de células de la médula ósea nucleadas en pacientes con infarto de miocardio con elevación del segmento ST (STEMI) y fracción de eyección ventricular izquierda (LVEF) moderadamente reducida".[34] Otro ensayo señala además cumplió con ningún criterios de valoración clínica dluego de realizarse una serie de ensayos con lecturas de imagen por resonancia magnética sin beneficios en la estructura y función cardíacas,[35] lo que llevó a la conclusión de que la terapia intracoronaria de células madre de médula ósea no ofrece un beneficio funcional o clínico.[36]
La formación de células sanguíneas
editarLa especificidad del repertorio de células inmunitarias humanas permite al cuerpo humano defenderse de antígenos de adaptación rápida. Sin embargo, el sistema inmunológico es vulnerable a su degradación por culpa de algunas enfermedades y, a causa del papel que desempeña en la defensa, su degradación puede ser fatal. La especificidad de las células inmunitarias es lo que permite el reconocimiento de antígenos extraños, lo que causa más desafíos en el tratamiento de enfermedades inmunitarias. Se deben hacer coincidencias idénticas entre el donante y el receptor para los tratamientos de trasplante exitosos, pero las coincidencias son poco comunes, incluso entre familiares de primer grado. La investigación que utiliza tanto células madre hematopoyéticas adultas como células madre embrionarias ha proporcionado información sobre los posibles mecanismos y métodos de tratamiento para muchas de estas dolencias.
Pueden ser generados ex vivo glóbulos rojos humanos completamente maduros usando células madre hematopoyéticas (HSC), ya que son sus precursoras. Para producirlas se cultivan junto con las células estromales creando un entorno que imita las condiciones de la médula ósea, el sitio natural del crecimiento de las células rojas de la sangre. Se agrega eritropoyetina, un factor de crecimiento, que incita a las células madre a diferenciarse en glóbulos rojos.[37] Se espera que el desarrollo de esta técnica beneficie al paciente y permita avances en la terapia génica, la transfusión de sangre y la medicina tópica.
Dientes que vuelven a crecer
editarEn 2004, los científicos del King's College de Londres descubrieron una forma de cultivar un diente completo en ratones[38] y pudieron desarrollar dientes en el laboratorio. Los investigadores confían en que la tecnología de regeneración dental se puede utilizar para desarrollar dientes vivos en las personas.
En teoría, las células madre extraídas del paciente podrían ser inducidas de tal manera que se transforme en un brote dental que, cuando se implanta en las encías, dará lugar a un nuevo diente, el cual crecerá en un período de tiempo de tres semanas, o al menos así se espera.[39] Se fusionaran con la mandíbula y liberará sustancias químicas que estimulan a los nervios y los vasos sanguíneos conectarse con ella. El proceso es similar al que forma los dientes adultos originales. Sin embargo, aún quedan muchos desafíos antes de que las células madre puedan ser una opción para reemplazar los dientes perdidos.[40][41]
Recrecimiento de células ciliadas cocleares
editarHay investigaciones que informan el éxito en el recrecimiento de las células ciliadas de la cóclea con el uso de células madre embrionarias.[42]
Ceguera y deficiencia visual
editarDesde 2003, se ha trasplantado con éxito células madre de la córnea en ojos dañados para restaurar la visión. "Las láminas de células de la retina utilizadas por el equipo se recolectan de fetos abortados, lo que a algunas personas les resulta objetable". Cuando estas láminas se trasplantan sobre la córnea dañada, las células madre estimulan la reparación y finalmente restauran la visión.[43] En 2005, investigadores del Hospital Queen Victoria de Sussex, Inglaterra, pudieron restaurar la vista de cuarenta personas con la misma técnica. El grupo, dirigido por Sheraz Daya, pudo utilizar con éxito células madre adultas obtenidas de un paciente, un familiar o incluso un cadáver. Otras investigaciones están en curso.[44]
Células beta pancreáticas
editarLas células beta en personas con diabetes tipo 1 son incapaces de producir insulina.[45] En experimentos recientes, los científicos han podido inducir a las células madre embrionarias para que se conviertan en células beta en el laboratorio. En teoría, si las células beta se trasplantan con éxito, podrán reemplazar las que funcionan mal en un paciente diabético.[46]
Ortopedia
editarEl uso de células madre mesenquimales (MSC) derivadas de células madre adultas se encuentra bajo investigación preliminar para posibles aplicaciones ortopédicas en traumatismo óseo y muscular, reparación de cartílago, osteoartritis, cirugía de disco intervertebral, cirugía del manguito rotador y trastornos musculoesqueléticos, entre otros.[47] Otras áreas de investigación incluyen ingeniería de tejidos y medicina regenerativa.[47]
Curación de heridas
editarLas células madre también se pueden utilizar para estimular el crecimiento de los tejidos humanos. En un adulto, el tejido lesionado suele ser reemplazado por tejido cicatricial, que se caracteriza por ser una estructura desorganizada de colágeno, ausencia de los folículos pilosos y estructura vascular irregular. Siferente es lo que pasa en el tejido fetal lesionado donde el tejido lesionado se reemplaza por tejido normal a través de la actividad de las células madre.[48] Un posible método para la regeneración de tejidos en adultos es colocar "semillas", que serían las células madre adultas, dentro de un "suelo", que sería el lecho de la herida. Este método provoca una respuesta regenerativa más parecida a la cicatrización de heridas fetales que la formación de tejido cicatricial en adultos. Esta área todavía sigue en investigación.[48] Dada su capacidad de regeneración se investiga que puedan tratar heridas refractarias inclusive las del cáncer de piel.[49]
Infertilidad
editarEl cultivo de células madre embrionarias humanas en fibroblastos de ovario porcino inactivados mitóticamente (POF) causa la diferenciación en células germinales (células precursoras de ovocitos y espermatozoides), como lo demuestra el análisis de expresión génica.[50]
Se logró estimular células madre embrionarias humanas para formar células similares a espermatozoides, las cuales estaban algo mal formadas.[51] Esto da esperanzas para el tratamiento de la azoospermia .
En 2012, se aislaron células madre oogoniales de ratones adultos y ovarios humanos y se demostró que eran capaces de formar ovocitos maduros.[52] Estas células tienen el potencial de tratar la infertilidad.
En 2020 se lleva a cabo un trasplante autólogo de médula ósea en ovario en mujeres con baja reserva ovárica y fallo ovárico precoz, para rejuvenecimiento del nicho ovárico y favorecimiento del desarrollo folicular. Se destaca la investigación que demuestra el potencial regenerativo de las células madre derivadas de médula ósea (BMDSC) en ratones con baja respuesta ovárica e insuficiencia ovárica prematura.
El grupo de investigación llevó a cabo un estudio experimental en modelos animales y validó los resultados en tejido ovárico humano xenotrasplantado en ratones inmunodeficientes. Basándose en estos resultados y estudios previos, sugieren que las terapias con BMDSC podrían ser una alternativa para mejorar el potencial reproductivo en pacientes con baja respuesta ovárica e insuficiencia ovárica prematura.
Se describe un estudio piloto llamado ASCOT (trasplante ovárico autólogo de células madre), donde el trasplante de BMDSC en la arteria ovárica demostró un aumento significativo en la reserva ovárica en pacientes con baja respuesta ovárica. Se destaca que algunos pacientes experimentaron la vuelta de la menstruación y mejoras en los niveles de FSH. El artículo concluye sugiriendo que las terapias basadas en BMDSC podrían representar una alternativa futura para aumentar el potencial reproductivo en pacientes con baja respuesta ovárica e insuficiencia ovárica prematura[53].
VIH / SIDA
editarEl virus del VIH destruye el sistema inmunológico ya que produce la pérdida de linfocitos T CD4+ en la sangre periférica y los tejidos linfoides. Su ingreso en los linfocitos CD4+ está mediada por la interacción con un receptor de quimiocinas celulares, siendo los más comunes CCR5 y CXCR4. Debido a esto los linfocitos CD4 + activados son los objetivos principales de la infección por VIH productiva.[54] Recientemente, los científicos han estado investigando un enfoque alternativo para tratar el VIH-1/SIDA, basado en la creación de un sistema inmunitario resistente a las enfermedades mediante el trasplante de células progenitoras y células progenitoras autólogas modificadas genéticamente para ser resistentes al VIH-1.[55]
Ensayos clínicos
editarEl primer ensayo clínico de una terapia basada en células madre embrionarias en humanos fue realizado por Geron Corporation. El 23 de enero de 2009, la Administración de Alimentos y Medicamentos de EE. UU. autorizó a Geron Corporation iniciarla. El objetivo del ensayo fue evaluar el fármaco GRNOPC1, células progenitoras de oligodendrocitos derivadas de células madre embrionarias, en personas con lesión de la médula espinal aguda . El ensayo se suspendió en noviembre de 2011 para que la empresa pudiera centrarse en las terapias en el "entorno actual de escasez de capital y condiciones económicas inciertas".[56] En 2013 la biotecnología y la medicina regenerativa empresa BioTime adquirió los activos de células madre de Geron en una transacción de acciones, con el objetivo de reiniciar el ensayo clínico.[57]
Modelos de tratamiento regenerativo
editarSe cree que las células madre median en la reparación a través de cinco mecanismos principales: 1) proporcionan un efecto antiinflamatorio, 2) se dirigen a los tejidos dañados y reclutan otras células, como las células progenitoras endoteliales, que son necesarias para el crecimiento del tejido, 3) el remodelado del tejido de soporte sobre la formación de cicatrices, 4) inhibiendo la apoptosis , y 5) diferenciando en hueso, cartílago, tendón y tejido del ligamento.[58][59]
Para enriquecer el suministro de sangre a las áreas dañadas y, en consecuencia, promover la regeneración de tejidos, se usa plasma rico en plaquetas junto con el trasplante de células madre.[60][61] La eficacia de algunas poblaciones de células madre también puede verse afectada por la manera como son implantadas; por ejemplo, para regenerar el hueso, las células madre a menudo se introducen en un andamio donde producen los minerales necesarios para la generación de hueso funcional.[60][61][62][63]
También se ha demostrado que las células madre tienen baja inmunogenicidad debido a que se encuentran en su superficieal número relativamente bajo de moléculas MHC. Además, se ha encontrado que secretan quimiocinas que alteran la respuesta inmune y promueven la tolerancia al nuevo tejido. Esto permite disminuir el riesgo de rechazo en tratamientos alogénicos. [61]
Células de raíz también han sido mostradas para tener un bajo immunogenicity debido al número relativamente bajo de MHC las moléculas encontradas en su superficie. Además, han sido encontrados para ocultar chemokines aquello altera la respuesta inmune y promover tolerancia del tejido nuevo. Esto deja para allogeneic tratamientos para ser actuados sin un riesgo de rechazo alto.[64]
Descubrimiento de fármacos e investigación biomédica
editarLa capacidad de desarrollar tejidos adultos funcionales de forma indefinida en cultivos a través de la diferenciación dirigida crea nuevas oportunidades para la investigación de medicamentos. Los investigadores pueden desarrollar líneas celulares diferenciadas y luego probar nuevos medicamentos en cada tipo de célula para examinar posibles interacciones in vitro antes de realizar estudios in vivo. El acceso a diversas líneas celulares permitirá disminuir la necesidad de animales de investigación, ya que los efectos en el tejido humano in vitro proporcionarán información que no se conoce normalmente antes de la fase de prueba en animales.[65]
Biología de la conservación
editarLas células madre están siendo exploradas para su uso en los esfuerzos de conservación de especies. Una investigación recolectó células madre espermatogoniales de una rata y las colocó en un ratón. Este hospedador produjo espermatozoides completamente maduros con la capacidad de producir descendientes viables. Actualmente se están realizando investigaciones para encontrar hospedadores adecuados para la introducción de células madre espermatogoniales de donantes. Si esto se convierte en una opción viable, los espermatozoides pueden producirse a partir de individuos de alta calidad genética que mueren antes de alcanzar la madurez sexual, preservando un linaje que de otro modo se perdería.[66]
Con la llegada de las células madre pluripotentes inducidas (iPSC), se están explorando y creando tratamientos para el uso en animales de baja producción en peligro de extinción. En lugar de tener que recolectar embriones o óvulos, que son limitados, los investigadores pueden eliminar las células madre mesenquimales con mayor facilidad y reduciendo en gran medida el peligro para el animal debido a las técnicas no invasivas. Esto permite que los huevos limitados se utilicen solo con fines reproductivos.[65]
Fuentes para células madre
editarLa mayoría de las células madre destinadas a la terapia regenerativa suelen aislarse de la médula ósea del paciente o de su tejido adiposo.[61][63] Las células madre mesenquimales pueden diferenciarse en células que forman el hueso, cartílago, tendones y ligamentos, así como en los tejidos musculares, neurales y otros. Estas son el tipo principal de células madre estudiadas en el tratamiento de enfermedades que afectan a estos tejidos.[67][68] El número de células madre trasplantadas en un tejido dañado puede influir en eficacia del tratamiento. En consecuencia, las células madre se cultivan como pasa en las derivadas de aspirados de médula ósea.[61][63] Aunque el tejido derivado de tejido adiposo también requiere procesamiento antes de su uso, la metodología de cultivo para las células madre derivadas de tejido adiposo no es tan extensa como la de las células derivadas de la médula ósea.[69][70] Si bien se piensa que las células madre derivadas de la médula ósea se prefieren para la reparación de huesos, cartílagos, ligamentos y tendones, otros creen que las técnicas de recolección menos complejas y el microentorno multicelular ya están presentes en los tejidos adiposos. Debido a esto las células madre del tejido adiposo son la fuente preferida para el trasplante autólogo.[60]
Se están investigando nuevas fuentes de células madre mesenquimales, incluidas las células madre presentes en la piel y la dermis. Estas son de interés debido a la facilidad con la que se pueden recolectar con un riesgo mínimo para el animal.[71] También se ha descubierto que las células madre hematopoyéticas viajan en el torrente sanguíneo y poseen la misma capacidad de diferenciación que otras células madre mesenquimales y pueden extraerse con una técnica de recolección muy no invasiva.[72] Hay interés el uso de células madre mesenquimáticas embrionarias. Se están realizando investigaciones para examinar las capacidades de diferenciación de las células madre que se encuentran en el cordón umbilical, el saco vitelino y la placenta de diferentes animales. Se cree que estas células madre tienen más capacidad de diferenciación que sus contrapartes adultas, teniendo la ventaja adicional de que forman más fácilmente tejidos de origen endodérmico y ectodérmico.[64]
Líneas de células madre embrionarias
editarExiste una amplia controversia sobre el uso de células madre embrionarias humanas. Esta controversia se dirige, principalmente, a las técnicas utilizadas para derivar nuevas líneas de células madre embrionarias, que a menudo requieren la destrucción del blastocisto. La oposición al uso de células madre embrionarias humanas en la investigación se vale de argumentaciones filosóficas, morales o religiosas.[73] Cabe recalcar que no todas las investigaciones con células madre implican implican la destrucción de un embrión humano como las que involucran células madre adultas, células madre amnióticas y células madre pluripotentes inducidas.
El primer ensayo clínico de una terapia basada en células madre embrionarias en humanos fue realizado por Geron Corporation. El 23 de enero de 2009, la Administración de Alimentos y Medicamentos de EE.UU. autorizó a Geron Corporation iniciarla. El objetivo del ensayo fue evaluar el fármaco GRNOPC1, células progenitoras de oligodendrocitos derivadas de células madre embrionarias, en personas con lesión de la médula espinal aguda . El ensayo se suspendió en noviembre de 2011 para que la empresa pudiera centrarse en las terapias en el "entorno actual de escasez de capital y condiciones económicas inciertas".[56] En 2013 la biotecnología y la medicina regenerativa empresa BioTime adquirió los activos de células madre de Geron en una transacción de acciones, con el objetivo de reiniciar el ensayo clínico.[57]
Células estromales mesenquimales (MSCs)
editarSe describió que las células estromales mesenquimales, cuando se transfunden dentro de unas pocas horas después de la descongelación, muestran una eficacia disminuida en el tratamiento de enfermedades en comparación con aquellas que están en la fase logarítmica del crecimiento celular. Esto hace que sea necesario llevar a las células estromales mesenquimales a su fase logarítmica de crecimiento antes de que se administren para ensayos clínicos o terapias experimentales.[74]
Críticas
editarEn 2013, se encontró que los estudios de células madre de médula ósea autólogas en que median la función ventricular contenían "cientos" de discrepancias.[26]Francis, Darrel P (Oct 2013). «Autologous bone marrow-derived stem cell therapy in heart disease: Discrepancies and contradictions». Int J Cardiol 168 (4): 3381-403. PMID 23830344. doi:10.1016/j.ijcard.2013.04.152.</ref> Los críticos informan que de los 48 informes parecía haber solo cinco ensayos subyacentes, y que en muchos casos, ya sea que fueran aleatorios o simplemente observadores aceptadores contra rechazadores, presentaban contradicciones entre los informes del mismo ensayo. Un par de informes con características de línea de base idénticas y resultados finales se presentaron en dos publicaciones como un ensayo aleatorizado de 578 pacientes y un estudio observacional de 391 sujetos. Otros informes requerían (imposibles) desviaciones estándar negativas en subconjuntos de personas, o contenían sujetos fraccionarios, o contenían clases NYHA (clasificación para clasificar el grado de insuficiencia cardíaca) negativas. Hasta hubo publicaciones donde había más personas que recibieron células madre en ensayos, que la cantidad de células madre procesadas en el laboratorio del hospital durante ese tiempo. Una investigación universitaria, cerrada en 2012 sin producir reportes, se reabrió en julio de 2013.[75]
En 2014, un metaanálisis sobre la terapia con células madre utilizando células madre de médula ósea para enfermedades del corazón reveló discrepancias en los informes de ensayos clínicos publicados, observándose que en los estudios con un mayor número de discrepancias mostraban un aumento en el tamaño del efecto.32 Otro metanálisis basado en los datos de diseños experimentales intra-sujetos de 12 ensayos aleatorios no pudo encontrar ningún beneficio significativo de la terapia con células madre en los criterios de valoración clínicos primarios, como eventos adversos mayores o aumento en las medidas de la función cardíaca, concluyendo que no hubo beneficio.33
Un ensayo sobre el tiempo en la evaluación del infarto de miocardio (por cuestiones de mercadotecnia se pone el nombre de TIME trial), que utilizó un diseño de ensayo aleatorizado, doble ciego, controlado con placebo, concluyó que "la administración de células mononucleares de la médula ósea no mejoró la recuperación de la función del ventrículo izquierdo durante 2 años" en las personas que tuvieron un infarto de miocardio.34 En consecuencia, un estudio controlado aleatorizado sobre la transferencia de médula ósea para mejorar la regeneración del infarto de elevación del ST (por motivos mercadotecnios BOOST-2 trial, llamándose con -2 para diferenciarse de un estudio anterior. Las siglas provienen de BOne marrOw transfer to enhance ST-elevation infarct regeneration) realizado en 10 centros médicos en Alemania y Noruega informó que el resultado del ensayo no apoya el uso de células de la médula ósea nucleadas en pacientes con infarto de miocardio con elevación del segmento ST (STEMI) y fracción de eyección ventricular izquierda (LVEF) moderadamente reducida".35 Otro ensayo señala además cumplió con ningún criterios de valoración clínica dluego de realizarse una serie de ensayos con lecturas de imagen por resonancia magnética sin beneficios en la estructura y función cardíacas,36 lo que llevó a la conclusión de que la terapia intracoronaria de células madre de médula ósea no ofrece un beneficio funcional o clínico.37
Medicina veterinaria
editarSe han realizado investigaciones en caballos, perros y gatos que pueden beneficiar el desarrollo de tratamientos con células madre en medicina veterinaria y pueden tratar una amplia gama de lesiones y enfermedades como infarto de miocardio, accidente cerebrovascular, daño de tendones y ligamentos, osteoartritis, osteocondrosis y distrofia muscular tanto en animales grandes, como en humanos.[76][77][78][79] Si bien la investigación de terapias basadas en células generalmente refleja las necesidades médicas humanas, el alto grado de frecuencia y gravedad de ciertas lesiones en caballos de carreras puso la medicina veterinaria a la vanguardia de este novedoso enfoque regenerativo.[80] Los animales de compañía pueden servir como modelos clínicamente relevantes que imitan de cerca a las enfermedades humanas.[81][82]
Fuentes de células madre
editarLas aplicaciones veterinarias de la terapia con células madre como medio de regeneración tisular han sido moldeadas en gran medida por investigaciones que comenzaron con el uso de células madre mesenquimales derivadas de adultos para tratar animales con lesiones o defectos que afectan los huesos, cartílagos, ligamentos y tendones.[83][67][84] Existen dos categorías principales de células madre utilizadas para los tratamientos: células madre alogénicas derivadas de un donante genéticamente diferente dentro de la misma especie[63][85] y células madre mesenquimáticas autólogas, derivadas del paciente.[60] Una tercera categoría, las células madre xenogénicas son derivadas de diferentes especies, actualmente usada para fines de investigación.[65]
Reparación de hueso
editarEl hueso tiene un proceso de curación natural único y bien documentado que normalmente es suficiente para reparar fracturas y otras lesiones comunes. Las roturas mal alineadas debido a un traumatismo grave, así como ciertos tratamientos como la resección de tumores de cáncer de hueso, son propensas a una curación inadecuada si dejan solo al proceso natural. Los andamios compuestos de componentes naturales y artificiales se siembran con células madre mesenquimales y se colocan en el defecto. Dentro de las cuatro semanas de colocar el andamio, el hueso recién formado comienza a integrarse con el hueso viejo y dentro de las 32 semanas, se logra la unión completa.[86] Se necesitan más estudios para caracterizar completamente el uso de terapias basadas en células para el tratamiento de fracturas óseas.
Las células madre también se usan para tratar enfermedades degenerativas de los huesos. El tratamiento normalmente recomendado para los perros que tienen la enfermedad de Legg-Calve-Perthes es quitar la cabeza del fémur después de que la degeneración haya progresado. Recientemente, se inyectaron células madre mesenquimales directamente en la cabeza del fémur, con éxito no solo en la regeneración ósea, sino también en la reducción del dolor.[86]
Reparación de ligamentos y tendones
editarTratamientos con células madre autólogas para la lesión del ligamento, la lesión del tendón, la osteoartritis, la osteocondrosis y los quistes subcondrales están disponibles comercialmente para los veterinarios en ejercicio para tratar a los caballos desde 2003 en los Estados Unidos y desde 2006 en el Reino Unido. Los veterinarios en los Estados Unidos también tienen disponibles tratamientos basados en células madre autólogas para la lesión del tendón, la lesión del ligamento y la osteoartritis en perros. Más de 3000 caballos y perros de propiedad privada han sido tratados con células madre autólogas derivadas de tejido adiposo. La eficacia de estos tratamientos se ha demostrado en ensayos clínicos de doble ciego para perros con osteoartritis de la cadera y el codo y caballos con daño en los tendones.[87][88]
Los caballos de carrera son especialmente propensos a las lesiones del tendón y los ligamentos. Las terapias convencionales no logran que el caballo recupere su potencial de funcionamiento completo. La curación natural, guiada por los tratamientos convencionales, conduce a la formación de tejido fibroso cicatricial que reduce la flexibilidad y el movimiento completo de la articulación. Los tratamientos tradicionales impidieron que una gran cantidad de caballos volvieran a la actividad completa y también tienen una alta reincidencia de lesiones debido a la naturaleza rígida del tendón cicatrizado. La introducción de células madre derivadas tanto de la médula ósea como de la grasa, junto con el estímulo mecánico natural promueve la regeneración del tejido del tendón. El movimiento natural promovió la alineación de las nuevas fibras y tendocitos con la alineación natural que se encuentra en los tendones no lesionados.[64]
El uso de células madre embrionarias también se ha aplicado a la reparación del tendón. Las células madre embrionarias mostraron tener una mejor tasa de supervivencia en el tendón, así como mejores capacidades de migración para llegar a todas las áreas del tendón dañado. La calidad general de la reparación también fue mayor, con una mejor arquitectura tendinosa y colágeno formado. Tampoco se observó formación de tumores durante el período experimental de tres meses. Se deben realizar estudios a largo plazo para examinar la eficacia a largo plazo y los riesgos asociados con el uso de células madre embrionarias.[64] Se han encontrado resultados similares en animales pequeños.[64]
Reparación de articulaciones
editarLa osteoartritis es la principal causa de dolor en las articulaciones tanto en animales como en humanos. Los caballos y los perros son los más frecuentemente afectados por la artritis. La regeneración del cartílago natural es muy limitada y no hay terapias farmacológicas actuales que sean curativas, solo buscan reducir los síntomas asociados con la degeneración. Todavía se están investigando diferentes tipos de células madre mesenquimáticas y otros aditivos para encontrar el mejor tipo de célula y método para el tratamiento a largo plazo.[64]
Las células mesenquimales derivadas de tejido adiposo son actualmente las más utilizadas debido a la recolección no invasiva. Ha habido éxito recientemente al inyectar células madre mesenquimales directamente en la articulación. Esta es una técnica no invasiva desarrollada recientemente que permite suministrarlas de manera sencilla. Los perros que recibieron este tratamiento mostraron mayor flexibilidad en sus articulaciones y menos dolor.[89]
Reparaciones musculares
editarLas células madre se han utilizado con éxito para mejorar la cicatrización en el corazón después de un infarto de miocardio en perros. Las células madre derivadas de la médula ósea y adiposas se indujeron a un destino de células cardíacas antes de inyectarlas en el corazón. Se encontró que el corazón tenía una contractilidad mejorada y una reducción en el área dañada cuatro semanas después de la aplicación de las células madre.[90]
Se está llevando a cabo un ensayo diferente para un parche hecho de una sustancia porosa sobre la cual se "siembren" células madre para inducir la regeneración de tejidos en defectos cardíacos. El tejido se regeneró y el parche se incorporó bien en al tejido cardíaco. Se cree que se debe, en parte, a la mejora de la angiogénesis y la reducción de la inflamación. Aunque los cardiomiocitos se produjeron a partir de las células madre mesenquimales, no parecían ser contráctiles. Otros tratamientos que indujeron un destino cardíaco en las células antes del trasplante tuvieron mayor éxito en la creación de tejido cardíaco contráctil.[91]
Reparaciones del sistema nervioso
editarLas lesiones de la médula espinal son uno de los traumas más comunes en los hospitales veterinarios.[86] Las lesiones de la columna vertebral ocurren de dos maneras después del trauma: el daño mecánico primario, y en procesos secundarios, como la inflamación y la formación de cicatrices, en los días posteriores al trauma. Estas células involucradas en la respuesta secundaria al daño secretan factores que promueven la formación de cicatrices e inhiben la regeneración celular. El tratamiento que se propone es usar células madre mesenquimales en un andamio poroso e implantarlo al sitio de la lesión y esperar que se transformen en células neurales. En este tratamiento células en el andamio secretan factores que contrarrestan los secretados por las células formadoras de cicatrices y promueven la regeneración neural. Ocho semanas después, los perros tratados con células madre mostraron una mejoría inmensa si los comparamos con los perros tratados con terapias convencionales de tal manera que los perros tratados con células madre a veces podían soportar su propio peso, lo que no se observa en perros que se someten a terapias convencionales.[92][93][94]
También hay tratamientos para reparar y regenerar los nervios periféricos. Es más probable que los nervios periféricos se dañen, pero los efectos del daño no son tan generalizados como se ve en las lesiones de la médula espinal. Los tratamientos se encuentran actualmente en ensayos clínicos para reparar nervios cortados, con éxito temprano con células madre inducidas a un destino neural inyectado en un nervio cortado. Dentro de cuatro semanas, se observó la regeneración de células madre previamente dañadas y haces de nervios completamente formados.[71]
Las células madre también están en fases clínicas para el tratamiento en oftalmología. Las células madre hematopoyéticas se han utilizado para tratar las úlceras corneales de origen diferente de varios caballos. Estas úlceras fueron resistentes a los tratamientos convencionales disponibles, pero respondieron rápidamente de manera positiva al tratamiento con células madre. Las células madre también pudieron restaurar la vista en el ojo de un caballo con desprendimiento de retina, lo que permitió que el caballo volviera a sus actividades diarias.[72]
Odontología regenerativa
editarLa inyección local de células estromales mesenquimales favorece la vascularización y la epitelización en la gingiva.[95]
Sociedad y cultura
editarMercadotecnia
editarA fines de la década de 1990 y principios de la década de 2000, hubo una ola de compañías y clínicas que ofrecían terapia con células madre a personas desesperadas, a menudo con afirmaciones extraordinarias sobre lo que podían hacer las células madre. Dichas compañías y clínicas incluyeron Advanced Cell Therapeutics, Stowe BioTherapy, Cells4Health dirigida por Cornelis Kleinbloesem, el Instituto Beijing Xishan para la neurorregeneración y la recuperación funcional en Shijingshan, dirigida por Huang Hongyun, y EmCell en Kiev, Ucrania dirigida por Alexandr Smikodub.[96][97] Estas clínicas hicieron fuertes afirmaciones sobre sus resultados, pero rara vez publicaron sus protocolos o investigaciones rigurosas que demostraran que sus terapias eran seguras y efectivas.[96]
Para 2012, había surgido una segunda ola de empresas y clínicas, generalmente ubicadas en países en desarrollo donde la medicina está menos regulada y que ofrecen terapias con células madre en un modelo de turismo médico.[97][98] Al igual que las empresas y clínicas First Wave, han hecho afirmaciones similares y no han publicado sus protocolos ni investigaciones rigurosas; México, Tailandia y la India han sido centros de esta actividad,[97] [96] al igual que Sudáfrica.[98]
En 2018, la FDA envió una carta de advertencia a StemGenex Biologic Laboratories en San Diego, que comercializaba un servicio en el que tomaba grasa corporal de las personas, la procesaba en mezclas que, según decía, contenía varias formas de células madre, y las administraba a la persona por inhalación, endovenosa o infusión en la médula espinal; la compañía dijo que el tratamiento era útil para muchas afecciones crónicas y potencialmente mortales.[2]
En 2018, la Comisión Federal de Comercio de EE. UU. descubrió que centros de salud y médicos realizaban afirmaciones sin fundamento para terapias con células madre por lo que se les impuso multas de $ 500 000.[99]
Belleza
editarDesde hace algunos años, algunos sectores como el de la belleza, específicamente el capilar, han conseguido en las células vegetales una aplicación excelente. La terapia con células madres de manzana, no produce efectos secundarios en el cabello si se utiliza 30 minutos antes del lavado. Esto se debe, a que pueden reproducirse auto renovarse y dividirse en su proceso de mitosis, resultando geniales cuando de restaurar en cabello se trata.
Otra de las ventajas de utilizar este tipo de técnica, es que ayuda a limpiar el cuero cabelludo y estimula la producción de folículos capilares. Su presentación es en forma de ampollas y proporcionan un cabello sano y saludable, ya que lo nutren de forma natural llenándolo de brillo desde la raíz hasta la punta. Este tratamiento es recomendado cuando nos hemos sometido a varias decoloraciones químicas, calor y altas temperaturas u otras técnicas de moda aplicadas al cabello como el balayage o los highlights.
Sin embargo, se han encontrado evidencias de la eficacia de las células madres de manzana en un pelo sin tratamientos químicos previos, pero con un proceso de resequedad. Una de sus características, es que pueden renovarse de forma indefinida, es decir, no necesitan combinarse con otras células para reproducirse. Por tanto, al entrar en contacto con el cabello activan los folículos pilosos, que son los encargados de aportar vitalidad, grosor y evitar la pérdida del cabello (alopecia). En el caso particular de la alopecia androgénica, las células madres de manzana actúan directamente en la epidermis.
Actualmente, existen algunas líneas de productos capilares elaborados 100% a base de células madres de manzana altamente recomendados y utilizados por cientos de estilistas alrededor del mundo. Una de estas marcas es Ybera Paris cuya línea Discovery está elaborada para proteger y regenerar la estructura capilar a través de la actuación de la cadena de proteínas vegetales de esta fruta. Adicionalmente, ofrece protección contra los rayos UV y restaura el ADN de las hebras del pelo.
Véase también
editarReferencias
editar- ↑ Mahla RS (2016). «Stem cells application in regenerative medicine and disease threpeutics». International Journal of Cell Biology 2016 (7): 1-24. PMC 4969512. PMID 27516776. doi:10.1155/2016/6940283.
- ↑ a b «FDA presses its campaign against rogue regenerative med players, cites StemGenex for illegal sales». 14 de noviembre de 2018. Consultado el 23 de marzo de 2019.
- ↑ Trasplante de Meollo del hueso y Célula de Raíz de Sangre Periférica Trasplante En Hecho de Instituto de Cáncer Nacional sitio de web de la Hoja. Bethesda, MD: Institutos Nacionales de Salud, Departamento de EE.UU. de Salud y Servicios Humanos, 2010. Citado 24 agosto 2010
- ↑ Ian Murnaghan para Explorar Células de Raíz. Actualizado: 16 diciembre 2013 Por qué Actuar una Célula de Raíz Trasplanta?
- ↑ «Twenty years of unrelated donor hematopoietic cell transplantation for adult recipients facilitated by the National Marrow Donor Program». Biology of Blood and Marrow Transplantation 14 (9 Suppl): 8-15. 2008. PMID 18721775. doi:10.1016/j.bbmt.2008.06.006.
- ↑ «New Insight for the Diagnosis of Gastrointestinal Acute Graft-versus-Host Disease». Mediators Inflamm 2014: 701013. 2014. PMC 3964897. PMID 24733964. doi:10.1155/2014/701013.
- ↑ «Prochymal – First Stem Cell Drug Approved». 22 de mayo de 2012.
- ↑ «A Stem-Cell-Based Drug Gets Approval in Canada». 17 de mayo de 2012.
- ↑ Rosemann A (Dec 2014). «Why regenerative stem cell medicine progresses slower than expected». J Cell Biochem 115 (12): 2073-76. PMID 25079695. doi:10.1002/jcb.24894.
- ↑ European Medicines Agency. «First stem-cell therapy recommended for approval in EU». Archivado desde el original el 21 de diciembre de 2014. Consultado el 12 de diciembre de 2014.
- ↑ Maguire, G (12 de mayo de 2016). «Therapeutics from Adult Stem Cells and the Hype Curve.». ACS Medicinal Chemistry Letters 7 (5): 441-43. PMC 4867479. PMID 27190588. doi:10.1021/acsmedchemlett.6b00125.
- ↑ Teixeira, Fábio G.; Carvalho, Miguel M.; Sousa, Nuno; Salgado, António J. (1 de octubre de 2013). «Mesenchymal stem cells secretome: a new paradigm for central nervous system regeneration?». Cellular and Molecular Life Sciences (en inglés) 70 (20): 3871-3882. ISSN 1420-682X. PMID 23456256. doi:10.1007/s00018-013-1290-8.
- ↑ Células de Raíz neuronal Pueden Rescatar la memoria En Alzheimer Adelantado es, Estudio de Ratón Sugiere
- ↑ a b Célula Basics: Qué es los usos potenciales de células de raíz humana y los obstáculos que tiene que ser vencido antes de estos usos potenciales serán dados cuenta?. En Información de Célula de la Raíz sitio de World Wide Web. Bethesda, MD: Institutos Nacionales de Salud, Departamento de EE.UU. de Salud y Servicios Humanos, 2009. Domingo citado, 26 abril 2009
- ↑ Vastag B (April 2001). «Stem cells step closer to the clinic: paralysis partially reversed in rats with ALS-like disease». JAMA 285 (13): 1691-93. PMID 11277806. doi:10.1001/jama.285.13.1691.
- ↑ Rebeiro P, Moore J (2016). «The role of autologous haemopoietic stem cell transplantation in the treatment of autoimmune disorders». Intern Med J 46 (1): 17-28. PMID 26524106. doi:10.1111/imj.12944.
- ↑ «Results Reported from Case Studies of Stem Cell Transplantation in People with Relapsing and Progressive MS». National MS Society. January 2015.
- ↑ «Notch signalling regulates stem cell numbers in vitro and in vivo». Nature 442 (7104): 823-26. August 2006. PMID 16799564. doi:10.1038/nature04940.
- ↑ «Targeting neural precursors in the adult brain rescues injured dopamine neurons». Proc. Natl. Acad. Sci. U.S.A. 106 (32): 13570-75. August 2009. PMC 2714762. PMID 19628689. doi:10.1073/pnas.0905125106.
- ↑ «Signaling pathways controlling neural stem cells slow progressive brain disease». Cold Spring Harb. Symp. Quant. Biol. 73: 403-10. 2008. PMID 19022746. doi:10.1101/sqb.2008.73.018.
- ↑ «A 37-year-old spinal cord-injured female patient, transplanted of multipotent stem cells from human UC blood, with improved sensory perception and mobility, both functionally and morphologically: a case study». Cytotherapy 7 (4): 368-73. 2005. PMID 16162459. doi:10.1080/14653240500238160.
- ↑ Team co-headed by researchers at Chosun University, Seoul National University and the Seoul Cord Blood Bank Archivado el 1 de mayo de 2007 en Wayback Machine. (SCB) Umbilical cord cells 'allow paralysed woman to walk' By Roger Highfield, Science Editor. Last Updated: 1:28AM GMT 30 November 2004
- ↑ «Human neural stem cells differentiate and promote locomotor recovery in spinal cord-injured mice». Proc. Natl. Acad. Sci. U.S.A. 102 (39): 14069-74. September 2005. PMC 1216836. PMID 16172374. doi:10.1073/pnas.0507063102.
- ↑ «Towards regenerative therapy for cardiac disease». The Lancet 379 (9819): 933-42. 2012. PMID 22405796. doi:10.1016/s0140-6736(12)60075-0.
- ↑ Strauer, Bodo; Steinhoff G (September 2011). «10 years of intracoronary and intramyocardial bone marrow stem cell therapy of the heart: from the methodological origin to clinical practice». J Am Coll Cardiol 58 (11): 1095-1104. PMID 21884944. doi:10.1016/j.jacc.2011.06.016.
- ↑ a b Francis, DP; Mielewczik, M; Zargaran, D; Cole, GD (26 de junio de 2013). «Autologous bone marrow-derived stem cell therapy in heart disease: Discrepancies and contradictions». International Journal of Cardiology 168 (4): 3381-403. PMID 23830344. doi:10.1016/j.ijcard.2013.04.152. Archivado desde el original el 21 de julio de 2013. Consultado el 23 de marzo de 2019.
- ↑ Schannwell CM, Köstering M, Zeus T, Brehm M, Erdmann G, Fleissner T, Yousef M, Kögler G, Wernet P, Strauer BE (2008). «Humane autologe Stammzelltransplantation zur Myokardregeneration bei dilatativer Kardiomyopathie (NYHA Stadium II bis III)». Austrian Journal of Cardiology 15 (1): 23-30.
- ↑ Kuswardhani R. A.; Soejitno A. (2011). «Bone marrow-derived stem cells as an adjunctive treatment for acute myocardial infarction: a systematic review and meta-analysis». Acta Medica Indonesiana 43 (3): 168-77. PMID 21979282.
- ↑ Malliaras K.; Kreke M.; Marban E. (2011). «The stuttering progress of cell therapy for heart disease». Clinical Pharmacology and Therapeutics 90 (4): 532-41. PMID 21900888. doi:10.1038/clpt.2011.175.
- ↑ Paul A.; Srivastava S.; Chen G.; Shum-Tim D.; Prakash S. (2011). «Functional Assessment of Adipose Stem Cells for Xenotransplantation Using Myocardial Infarction Immunocompetent Models: Comparison with Bone Marrow Stem Cells». Cell Biochemistry and Biophysics 67 (2): 263-73. PMID 22205499. doi:10.1007/s12013-011-9323-0.
- ↑ Nowbar, Alexandra N.; Mielewczik, Michael; Karavassilis, Maria; Dehbi, Hakim-Moulay; Shun-Shin, Matthew J.; Jones, Siana; Howard, James P.; Cole, Graham D. et al. (28 de abril de 2014). «Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis». BMJ (en inglés) 348: g2688. ISSN 1756-1833. PMC 4002982. PMID 24778175. doi:10.1136/bmj.g2688.
- ↑ Gyöngyösi, Mariann; Wojakowski, Wojciech; Lemarchand, Patricia; Lunde, Ketil; Tendera, Michal; Bartunek, Jozef; Marban, Eduardo; Assmus, Birgit et al. (10 de abril de 2015). «Meta-Analysis of Cell-based CaRdiac stUdiEs (ACCRUE) in Patients With Acute Myocardial Infarction Based on Individual Patient DataNovelty and Significance». Circulation Research (en inglés) 116 (8): 1346-1360. ISSN 0009-7330. PMC 4509791. PMID 25700037. doi:10.1161/CIRCRESAHA.116.304346.
- ↑ Traverse, Jay H.; Henry, Timothy D.; Pepine, Carl J.; Willerson, James T.; Chugh, Atul; Yang, Phillip C.; Zhao, David X.M.; Ellis, Stephen G. et al. (2 de febrero de 2018). «TIME Trial: Effect of Timing of Stem Cell Delivery Following ST-Elevation Myocardial Infarction on the Recovery of Global and Regional Left Ventricular FunctionNovelty and Significance». Circulation Research 122 (3): 479-488. PMC 5805626. PMID 29208679. doi:10.1161/CIRCRESAHA.117.311466.
- ↑ Wollert, Kai C; Meyer, Gerd P; Müller-Ehmsen, Jochen; Tschöpe, Carsten; Bonarjee, Vernon; Larsen, Alf Inge; May, Andreas E; Empen, Klaus et al. (14 de octubre de 2017). «Intracoronary autologous bone marrow cell transfer after myocardial infarction: the BOOST-2 randomised placebo-controlled clinical trial». European Heart Journal 38 (39): 2936-2943. PMID 28431003. doi:10.1093/eurheartj/ehx188.
- ↑ Bartunek, Jozef; Wojakowski, Wojtek (14 de octubre de 2017). «Intracoronary autologous bone marrow cell transfer after acute myocardial infarction: abort and refocus». European Heart Journal 38 (39): 2944-2947. PMID 28637251. doi:10.1093/eurheartj/ehx300.
- ↑ Gyöngyösi, Mariann; Lukovic, Dominika; Zlabinger, Katrin; Mandic, Ljubica; Winkler, Johannes; Gugerell, Alfred (1 de enero de 2017). «Cardiac Stem Cell-based Regenerative Therapy for the Ischemic Injured Heart — a Short Update 2017». Journal of Cardiovascular Emergencies (en inglés) 3 (2): 81-83. ISSN 2457-5518. doi:10.1515/jce-2017-0009.
- ↑ «Ex vivo generation of fully mature human red blood cells from hematopoietic stem cells». Nat. Biotechnol. 23 (1): 69-74. January 2005. PMID 15619619. doi:10.1038/nbt1047.
- ↑ Archer, Graeme. «Technology». London. Consultado el 24 de mayo de 2010.
- ↑ Anglin, Ian (26 de agosto de 2013). «Scientists Grow Teeth Using Stem Cells». SingularityHUB. Consultado el 31 de julio de 2014.
- ↑ «Stem cells and tooth tissue engineering». Cell Tissue Res. 331 (1): 359-72. January 2008. PMID 17938970. doi:10.1007/s00441-007-0467-6.
- ↑ «Stem cell-based biological tooth repair and regeneration». Trends in Cell Biology 20 (12): 715-22. December 2010. PMC 3000521. PMID 21035344. doi:10.1016/j.tcb.2010.09.012.
- ↑ Terapia de gen es primera sordera 'cura' @– salud @– 14 febrero 2005 @– Científico Nuevo
- ↑ El tejido fetal restaura vista perdida MedicalNewsToday. 28 octubre 2004
- ↑ BBC Inglaterra | NOTICIOSA | células de Raíz | de Condados Del sur utilizaron para restaurar visión
- ↑ «Adverse Effect of High Glucose Concentration on Stem Cell Therap». Int J Hematol Oncol Stem Cell Res 7 (3): 34-40. 2013. PMC 3913149. PMID 24505533.
- ↑ Goldstein, Ron (2007). Embryonic stem cell research is necessary to find a diabetes cure. Greenhaven Press. p. 44.
- ↑ a b Berebichez-Fridman, R.; Gómez-García, R.; Granados-Montiel, J.; Berebichez-Fastlicht, E.; Olivos-Meza, A.; Granados, J.; Velasquillo, C.; Ibarra, C. (2017). «The Holy Grail of Orthopedic Surgery: Mesenchymal Stem Cells—Their Current Uses and Potential Applications». Stem Cells International 2017: 1-14. PMC 5494105. PMID 28698718. doi:10.1155/2017/2638305.
- ↑ a b «Progress and potential for regenerative medicine». Annu. Rev. Med. 58 (1): 299-312. 2007. PMID 17076602. doi:10.1146/annurev.med.58.082405.095329.
- ↑ Rognoni, Emanuel; Watt, Fiona M. (2018). «Skin cell heterogeneity in development, wound healing, and cancer». Trends in Cell Biology 28 (9): 709-722. ISSN 0962-8924. PMC 6098245. PMID 29807713. doi:10.1016/j.tcb.2018.05.002.
- ↑ «Comparative evaluation of different in vitro systems that stimulate germ cell differentiation in human embryonic stem cells». Fertil. Steril. 93 (3): 986-94. December 2008. PMID 19064262. doi:10.1016/j.fertnstert.2008.10.030.
- ↑ Ledford H (7 de julio de 2009). «Sperm-like cells made from human embryonic stem cells». Nature News. doi:10.1038/news.2009.646. Archivado desde el original el 9 de mayo de 2011.
- ↑ White, YAR; Woods DC; Takai Y; Ishihara O; Seki H; Tilly JL. (2012). «Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women». Nature Medicine 18 (3): 413-21. PMC 3296965. PMID 22366948. doi:10.1038/nm.2669.
- ↑ Pellicer de Castellví, Nuria (2020). Trasplante autólogo de médula ósea en ovario en mujeres con baja reserva ovárica y fallo ovárico precoz, para rejuvenecimiento del nicho ovárico y favorecimiento del desarrollo folicular. Universitat de València. Consultado el 31 de diciembre de 2023.
- ↑ Allers, Kristinia; Hütter, Gero; Hofmann, Jörg; Loddenkemper, Chrtoph; Rieger, Kathrin; Thiel, Eckhard; Schneider, Thomas (14 de julio de 2014). «Evidence for the cure of HIV infection by CCR5Δ32/Δ32 stem cell transplantation». Blood 117 (10): 2791-99. PMID 21148083. doi:10.1182/blood-2010-09-309591.
- ↑ DiGiusto, David; Stan, Rodica; Krishnan, Amrita; Li, Haitang; Rossi, John; Zaia, John (22 de noviembre de 2013). «Development of Hematopoietic Stem Cell Based Gene Therapy for HIV-1 Infection: Considerations for Proof of Concept Studies and Translation to Standard Medical Practice». Viruses 2013 (5): 2898-919. PMC 3856421. PMID 24284880. doi:10.3390/v5112898.
- ↑ a b O'Connell, Claire (27 de enero de 2012). «Stem cells – where are we now?».
- ↑ a b «BioTime acquires stem cell assets from Geron, raises $10 million». 7 de enero de 2013.
- ↑ «Stem cells in veterinary medicine – attempts at regenerating equine tendon after injury». Trends Biotechnol. 25 (9): 409-16. September 2007. PMID 17692415. doi:10.1016/j.tibtech.2007.07.009.
- ↑ «Chondrogenesis, osteogenesis and adipogenesis of canine mesenchymal stem cells: a biochemical, morphological and ultrastructural study». Histochem. Cell Biol. 128 (6): 507-20. December 2007. PMID 17922135. doi:10.1007/s00418-007-0337-z.
- ↑ a b c d Kane, Ed (mayo 2008). Raíz-promesa de espectáculos de terapia de célula para daño de tejido blando, enfermedad. DVM Newsmagazine. 6E-10E.
- ↑ a b c d «Autogenous injectable bone for regeneration with mesenchymal stem cells and platelet-rich plasma: tissue-engineered bone regeneration». Tissue Eng. 10 (5–6): 955-64. 2004. PMID 15265313. doi:10.1089/1076327041348284.
- ↑ «The leading edge of stem cell therapeutics». Annu. Rev. Med. 58 (1): 313-28. 2007. PMID 17100553. doi:10.1146/annurev.med.58.070605.115252.
- ↑ a b c d Zachos TA, Smith TJ (septiembre 2008). Uso de células de raíz del adulto en clínicos orthopedics. DVM Newsmagazine. 36@–39.
- ↑ a b c d e f «Stem cell-based tissue engineering in veterinary orthopaedics». Cell Tissue Res. 347 (3): 677-88. 2012. PMID 22287044. doi:10.1007/s00441-011-1316-1.
- ↑ a b c «Stem cells and veterinary medicine: tools to understand diseases and enable tissue regeneration and drug discovery». Vet. J. 191 (1): 19-27. 2012. PMID 21958722. doi:10.1016/j.tvjl.2011.08.007.
- ↑ I. Dobrinski; A.J. Travis (2007). «Germ cell transplantation for the propagation of companion animals, non-domestic and endangered species». Reproduction, Fertility, and Development 19 (6): 732-39. doi:10.1071/RD07036.
- ↑ a b «Autologous mesenchymal stem cell-mediated repair of tendon». Tissue Eng. 5 (3): 267-77. June 1999. PMID 10434073. doi:10.1089/ten.1999.5.267.
- ↑ «Cell-based therapy in the repair of osteochondral defects: a novel use for adipose tissue». Tissue Eng. 9 (4): 733-44. August 2003. PMID 13678450. doi:10.1089/107632703768247412.
- ↑ «Fat tissue: an underappreciated source of stem cells for biotechnology». Trends Biotechnol. 24 (4): 150-54. April 2006. PMID 16488036. doi:10.1016/j.tibtech.2006.01.010.
- ↑ «Adipose tissue-derived stromal cells as a novel option for regenerative cell therapy». J. Atheroscler. Thromb. 13 (2): 77-81. April 2006. PMID 16733294. doi:10.5551/jat.13.77. Uso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b «Peripheral nerve regeneration using autologous porcine skin-derived mesenchymal stem cells». J Tissue Eng Regen Med 6 (2): 113-24. 2012. PMID 21337707. doi:10.1002/term.404.
- ↑ a b «Blood derived stem cells: an ameliorative therapy in veterinary ophthalmology». J. Cell. Physiol. 227 (3): 1250-56. 2012. PMID 21792938. doi:10.1002/jcp.22953.
- ↑ Mlsna, Lucas J. (2010). «Stem Cell Based Treatments and Novel Considerations for Conscience Clause Legislation». Indiana Health Law Review (United States) 8 (2): 471-96. ISSN 1549-3199. OCLC 54703225..
- ↑ «Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-γ licensing». Cytotherapy 14 (2): 147-52. February 2012. PMC 3279133. PMID 22029655. doi:10.3109/14653249.2011.623691.
- ↑ Berndt, Christina (4 de julio de 2013). «A minefield of contradictions». Suddeutsche Zeitung. Consultado el 6 de julio de 2013.
- ↑ «Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats». Stroke 32 (4): 1005-11. April 2001. PMID 11283404. doi:10.1161/01.STR.32.4.1005. Archivado desde el original el 26 de julio de 2012. Consultado el 23 de marzo de 2019.
- ↑ «Transplantation of Progenitor Cells and Regeneration Enhancement in Acute Myocardial Infarction (TOPCARE-AMI)». Circulation 106 (24): 3009-17. December 2002. PMID 12473544. doi:10.1161/01.CIR.0000043246.74879.CD.
- ↑ «Stem cell therapy in a caprine model of osteoarthritis». Arthritis Rheum. 48 (12): 3464-74. December 2003. PMID 14673997. doi:10.1002/art.11365.
- ↑ «Mesoangioblast stem cells ameliorate muscle function in dystrophic dogs». Nature 444 (7119): 574-79. November 2006. PMID 17108972. doi:10.1038/nature05282.
- ↑ «Mesenchymal stem cell therapy in equine musculoskeletal disease: scientific fact or clinical fiction?». Equine Vet. J. 39 (2): 172-80. March 2007. PMID 17378447. doi:10.2746/042516407X180868.
- ↑ «Embryonic stem cells in companion animals (horses, dogs and cats): present status and future prospects». Reprod. Fertil. Dev. 19 (6): 740-47. 2007. PMID 17714628. doi:10.1071/RD07039.
- ↑ «Stem cell therapy for joint problems using the horse as a clinically relevant animal model». Expert Opin Biol Ther 7 (11): 1621-26. November 2007. PMID 17961087. doi:10.1517/14712598.7.11.1621.
- ↑ «Use of mesenchymal stem cells in a collagen matrix for Achilles tendon repair». J. Orthop. Res. 16 (4): 406-13. July 1998. PMID 9747780. doi:10.1002/jor.1100160403.
- ↑ «The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects». J Bone Joint Surg Am 80 (7): 985-96. July 1998. PMID 9698003. doi:10.2106/00004623-199807000-00007. Archivado desde el original el 28 de julio de 2012.
- ↑ «Mesenchymal stem cells and bone regeneration». Vet Surg 35 (3): 232-42. April 2006. PMID 16635002. doi:10.1111/j.1532-950X.2006.00142.x.
- ↑ a b c Basic Science and Clinical Application of Stem Cells in Veterinary Medicine 123. 2010. pp. 219-63. ISBN 978-3-642-16050-9. doi:10.1007/10_2010_66.
- ↑ «Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs». Vet. Ther. 9 (3): 192-200. 2008. PMID 19003780.
- ↑ «Effect of adipose-derived nucleated cell fractions on tendon repair in horses with collagenase-induced tendinitis». Am. J. Vet. Res. 69 (7): 928-37. July 2008. PMID 18593247. doi:10.2460/ajvr.69.7.928.
- ↑ «Production of canine mesenchymal stem cells from adipose tissue and their application in dogs with chronic osteoarthritis of the humeroradial joints». Cell Biol. Int. 36 (2): 189-94. 2012. PMID 21936851. doi:10.1042/CBI20110304.
- ↑ «Homing of adipose-derived stem cells to radiofrequency catheter ablated canine atrium and differentiation into cardiomyocyte-like cells». Int. J. Cardiol. 146 (3): 371-78. 2011. PMID 19683815. doi:10.1016/j.ijcard.2009.07.016.
- ↑ «Tissue regeneration observed in a basic fibroblast growth factor–loaded porous acellular bovine pericardium populated with mesenchymal stem cells». The Journal of Thoracic and Cardiovascular Surgery 134 (1): 65-73.e4. 2007. ISSN 0022-5223. PMID 17599488. doi:10.1016/j.jtcvs.2007.02.019.
- ↑ Sung Su Park (2012). «Functional recovery after spinal cord injury in dogs treated with a combination of Matrigel and neural-induced adipose-derived mesenchymal Stem cells». Cytotherapy 14 (5): 584-97. PMID 22348702. doi:10.3109/14653249.2012.658913.
- ↑ «Functional recovery and neural differentiation after transplantation of allogenic adipose-derived stem cells in a canine model of acute spinal cord injury». J. Vet. Sci. 10 (4): 273-84. 2009. PMC 2807262. PMID 19934591. doi:10.4142/jvs.2009.10.4.273.
- ↑ «Safety of Autologous Bone Marrow Stromal Cell Transplantation in Dogs with Acute Spinal Cord Injury». Veterinary Surgery 41 (4): 437-42. 2012. ISSN 0161-3499. PMID 22548465. doi:10.1111/j.1532-950X.2011.00959.x.
- ↑ Kulakov, A.; Kogan, E.; Brailovskaya, T.; Vedyaeva, A.; Zharkov, N.; Krasilnikova, O.; Krasheninnikov, M.; Baranovskii, D. et al. (2021). «Mesenchymal Stromal Cells Enhance Vascularization and Epithelialization within 7 Days after Gingival Augmentation with Collagen Matrices in Rabbits». Dentistry Journal 9 (9): 101. ISSN 2304-6767. PMC 8469508. PMID 34562975. doi:10.3390/dj9090101. Consultado el 9 de noviembre de 2023.
- ↑ a b Enserink, M (14 de julio de 2006). «Biomedicine. Selling the stem cell dream.». Science 313 (5784): 160-3. PMID 16840673. doi:10.1126/science.313.5784.160.
- ↑ a b c Sipp, D (2017). «The malignant niche: safe spaces for toxic stem cell marketing.». NPJ Regenerative Medicine 2: 33. PMC 5736713. PMID 29302366. doi:10.1038/s41536-017-0036-x.
- ↑ a b Slabbert, Melodie (21 de agosto de 2015). «South Africa's struggle to control sham stem cell treatments» (en inglés).
- ↑ Colleen Tressler (18 de octubre de 2018). «FTC takes aim at deceptive stem cell therapy claims». US Federal Trade Commission. Consultado el 7 de marzo de 2019.
Enlaces externos
editar- Esta obra contiene una traducción total derivada de «Stem Cell therapy » de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.