Proteína tau
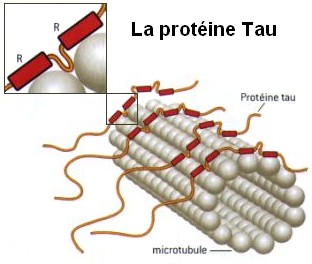
La proteína tau, abundante en el sistema nervioso central (SNC) y en el sistema nervioso periférico (SNP), radica a nivel neuronal en los axones. Su función está vinculada a la unión de los microtúbulos que a su vez se asocian a la tubulina para estabilizar el citoesqueleto neuronal.[1]
| Proteína tau asociada a microtúbulos | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||
| Identificadores | ||||
| Símbolos | [http://www.genenames.org/data/hgnc_data.php?hgnc_id=6893 MAPT (HGNC: 6893)] MTBT1, tau, PPND, FTDP-17, TAU, MSTD, MTBT2 | |||
| Identificadores externos | ||||
| Locus | Cr. 17 q21 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
Las tau son proteínas microtubulares prionoides muy poco frecuentes fuera del sistema nervioso central. Su principal función es la estabilización de los microtúbulos axonales a través de la interacción con la tubulina. Sin embargo, cuando la cinesina se adhiere a las tiras de la proteína tau, el motor tiende a desprenderse completamente del microtúbulo. De esta forma, la proteína tau ayuda a regular el equilibrio del tráfico de células nerviosas, lo que puede explicar que las alteraciones de tau se asocien con las patologías neurodegenerativas.[2] La modulación diferencial de la motilidad de la dineína y de la cinesina sugieren que las proteínas asociadas al microtúbulo pueden regular espacialmente el equilibrio del transporte axonal dependiente del microtúbulo. Dixit ha indicado que el objetivo de estudio ha sido analizar cómo la proteína tau controla el balance del transporte neuronal. Las tau fueron descubiertas en 1975 en la Universidad de Princeton en el laboratorio de Marc Kirschner.
Isoformas de la proteína tau
editarLa tau humana contiene seis isoformas que resultan de un proceso de empalme o también denominado como splicing alternativo, esto debido a que se originan diferentes especies de ARNm.[3]
El gen de la proteína tau se encuentra en el (brazo largo) en la banda q21, su transcrito primario consta de 16 exones y origina diferentes isoformas por procesamiento alternativo. En el SNC existen 6 isoformas de los exones 2,3 y 10. El transcrito primario de tau contiene 16 exones de los 2 son específicos de isoformas de tau en el SNP y los otros generan las seis isoformas humanas en el SNC (los exones 1,4,5,7,9,11,12 y 13 son constitutivos).[3]
La expresión de las distintas isoformas de tau es característica durante el desarrollo del cerebro. Las isoformas que carecen del exón 10 se encuentran en estadios del desarrollo temprano o en determinados tipos celulares.[3]
Modificaciones postraduccionales
editarLa proteína tau experimenta diferentes modificaciones postraduccionales como: fosforilación, glicosilación, ubicuitinación, oxidación y truncaciones.[4]
Fosforilación
Tau se ha definido como una fosfoproteína desde 1980, esto debido a estudios en la fosforilación de serina/treonina. Existen 79 sitios de fosforilación en la isoformas más larga de tau, dichos sitios se han dividido en 2 grupos: los que se modifican por cinasas dirigidas por prolina (cinasa glucógeno sintasa 3, GSK3) y los que pueden ser modificados por cinasa no dirigidas por prolina (proteína cinasa A, PKA).[4]
Glicosilación
Cuando Tau se encuentra hiperfosforilada se presenta una N-Glicosilación, mientras que la O-glicosilación se presenta en una tau no modificada.[4]
Ubiquitinación
La ubiquitinación de tau ocurre principalmente en los agregados aberrantes como los encontrados en la enfermedad de Parkinson, o los filamentos de pares helicoidales en la Enfermedad de Alzheimer.[4]
Oxidación
En el exón 10 de tau existe la posibilidad de formar enlaces disulfuro intramoleculares que resultan en la agregados aberrantes, lo cual da lugar a la oxidación de tau.[4]
Truncación
La truncación en tau, se define como la escisión de la misma, causada por una gran variedad proteasas, entre ellas se pueden mencionar algunas como: capasas, calpaínas, catepsinas. Las truncaciones de tau se han reportado en la enfermedad de alzheimer.[5]
Referencias
editar- ↑ Micheli, F.; Martín, A.N.; Aconapé, J.J.; Pardal, M.; Biller, J. (2003). Tratado de Neurología Clínica. España: Médica Panamericana.
- ↑ Sobre su relación con el Alzheimer, véase Meredith Wadman, «Alzheimer’s protein may spread like an infection, human brain scans suggest», sciencemag.org, 5-1-18.
- ↑ a b c Pérez, S.M.I. (2008). Estudios sobre la fosforilación y agregación de la proteína Tau y su posible relación con la enfermedad de Alzheimer. Madrid: Universidad Autónoma de Madrid.
- ↑ a b c d e AVILA, J; LUCAS, J.J; PÉREZ, M; HERNÁNDEZ, F. (2004). Role of Tau Protein in Both Physiological and Pathological Conditions 84.
- ↑ Hanger, D.P.; Wray, S. (2010). Tau cleavage and tau aggregation in neurodegenerative disease 38. doi:10.1042/BST0381016.