Sulfato de plomo(II)
Sulfato de plomo(II) (PbSO4) es un sólido cristalino o en forma de polvo, de color blanco. Se llama también vitriolo de plomo o anglesita. Es una de las pocas sales de plomo solubles en agua, aunque su solubilidad es baja.
| Sulfato de plomo(II) | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Tetraoxosulfato(VI) de plomo(II) | ||
| General | ||
| Otros nombres |
Sulfato de plomo(II) Sulfato plumboso Anglesita,[1] Plomo blanco Freeman. | |
| Fórmula semidesarrollada | PbSO4 | |
| Fórmula estructural |
Pb2+ + 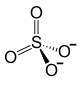 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7446-14-2[2] | |
| ChemSpider | 22441 | |
| PubChem | 16686003 24008, 16686003 | |
| UNII | C516H654O8 | |
| Propiedades físicas | ||
| Apariencia | Sólido cristalino blanco. | |
| Densidad | 6290 kg/m³; 6,29[3] g/cm³ | |
| Masa molar | 303,26 g/mol | |
| Punto de fusión | 1443 K (1170 °C) | |
| Estructura cristalina | Ortorrómbico | |
| Propiedades químicas | ||
| Solubilidad en agua | 44 mg/L ---[3] | |
| Producto de solubilidad | 2,53·10-8 ---[4] | |
| Termoquímica | ||
| ΔfH0sólido | -919,97 kJ/mol | |
| S0sólido | 148,5 J·mol–1·K–1 | |
| Peligrosidad | ||
| Frases R | 61-E20/22-33-50/53-62 | |
| Frases S | 53-45-60-61 | |
| Riesgos | ||
| Riesgos principales | es carcinogeno | |
| Ingestión | Corrosivo. Puede dañar severamente las membranas mucosas de la boca, garganta y estómago, provocando la muerte. Puede causar dolor de cabeza, fatiga, náuseas, vómitos y diarrea. Nocivo. | |
| Inhalación | Corrosivo. Produce daños en las mucosas del tracto respiratorio superior, así como irritación de los bronquios y pulmones. | |
| Piel | Corrosivo. Puede provocar enrojecimiento, dolor y quemaduras severas. | |
| Ojos | Corrosivo. Puede causar visión borrosa, enrojecimiento, dolor y quemaduras severas. | |
| LD50 | 30 g/kg (oral conejillo de indias) | |
| Compuestos relacionados | ||
| Otros cationes |
Sulfato de estaño(II) Sulfato de hierro(II) Sulfato de cobre(II) Sulfato de potasio | |
| Otros aniones |
Cloruro de plomo(II) Óxido de plomo(II) Nitrato de plomo(II) Oxalato de plomo(II) | |
| Otros compuestos de Pb y S |
Sulfato de plomo(IV) Sulfuro de plomo(II) Sulfito de plomo(II) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Se ve con frecuencia en los terminales o bornes de las baterías de coche, llamadas acumuladores de plomo o baterías de plomo y ácido. Se produce en su interior cuando la batería se descarga; luego, durante la recarga, se regenera de nuevo, originando plomo y ácido sulfúrico en el electrodo negativo, o bien dando óxido de plomo(IV) y ácido sulfúrico en el electrodo positivo.
Obtención
editarPuede extraerse a partir del mineral anglesita, que presenta la misma composición química, PbSO4, y también como producto de oxidación del mineral galena, sulfuro de plomo(II), PbS.
Otro método de obtención parte de la cerusita, un mineral que contiene carbonato de plomo(II) impuro. Se trata primero la muestra con ácido nítrico, con el fin del disolver al carbonato de plomo(II). Posteriormente, al agregar ácido sulfúrico, se precipita el sulfato de plomo(II).
El Sulfato de Plomo también puede obtenerse en solución al realizar una mezcla de soluciones de sulfato de sodio y nitrato de plomo.
Propiedades
editarEn solución ácida es poco reductor, pero lo es más en soluciones básicas pues puede oxidarse a plomo(IV). En el siguiente, se oxida a óxido de plomo(IV):
Toxicología
editarEs tóxico y corrosivo por inhalación, ingestión y contacto (véase ficha lateral). El plomo es un veneno acumulativo y la exposición a cantidades pequeñas puede aumentar el contenido corporal hasta llegar a niveles tóxicos, provocando anemia, daño renal, problemas de visión y daños en el sistema nervioso central, sobre todo en niños. Durante el embarazo produce efectos adversos para el feto. También puede perjudicar la fertilidad y producir alteraciones cardiovasculares.
Muy tóxico para los organismos acuáticos, puede provocar a largo plazo efectos negativos en el medio ambiente acuático.
El valor límite umbral o valor límite de exposición para esta sustancia es 0.15 mg/m³, por encima del cual la sustancia es perjudicial.[5]
Sulfatos de plomo(II) ácido y básico
editarSe conocen otros sulfatos de plomo(II):
- Sales mixtas sulfato-óxido en diferentes proporciones estequiométricas que se usan en la fabricación de baterías de plomo y ácido.:
PbSO4·PbO; PbSO4·2PbO; PbSO4·3PbO; PbSO4·4PbO.
- Un mineral relacionado es la leadhillita o maxita, una sal triple de nombre carbonato-hidróxido-sulfato de plomo(II), cuya fórmula es: 2PbCO3·PbSO4·Pb(OH)2.
- En concentraciones de ácido sulfúrico superiores al 80% se forma el sulfato ácido de plomo(II) o hidrógenosulfato de plomo(II), Pb(HSO4)2.[6]
Véase también
editarReferencias
editar- ↑ [1] Datos sobre la anglesita. Acceso a la página el 10-05-08
- ↑ Número CAS
- ↑ a b "CRC Handbook of Chemistry and Physics", 83rd Edition, CRC Press, 2002. (en Inglés)
- ↑ [2] Valores de constante de producto de solubilidad. Acceso a la página el 10-05-08
- ↑ Módulos de formación en seguridad química. Centro internacional sobre Seguridad e Higiene en el trabajo. Organización internacional de trabajadores (OIT). [3]
- ↑ Министерство образования и науки РФ, Реферат "Свинец и его свойства", 2007, «Copia archivada». Archivado desde el original el 21 de diciembre de 2007. Consultado el 27 de noviembre de 2007.
Enlaces externos
editar- Ficha de datos de seguridad Panreac: [4]
- Case Studies in Environmental Medicine (CSEM): Lead Toxicity (en inglés)
- ToxFAQs: Lead (en inglés)