Proceso reversible
Se denomina proceso reversible a aquel que hacen evolucionar a un sistema termodinámico desde un estado de equilibrio[1] inicial a otro nuevo estado de equilibrio final a través de infinitos estados de equilibrio.
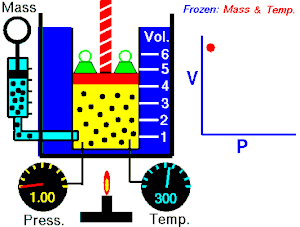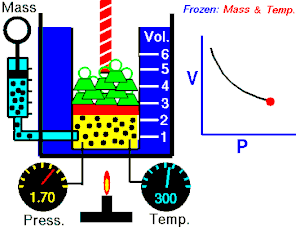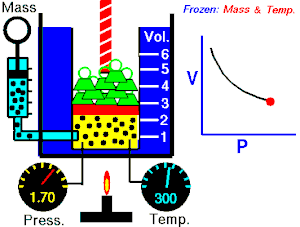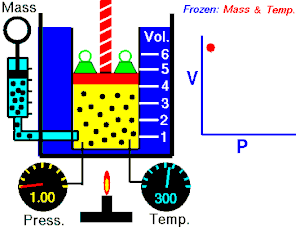
De una manera simplificada, se puede decir que un proceso reversible es aquel proceso que, después de ser llevado de un estado inicial a uno final, puede retomar sus propiedades originales.
Estos procesos son procesos ideales,[2] ya que el tiempo necesario para que se establezcan esos infinitos estados de equilibrio intermedio sería infinito.
La variación de las variables de estado del sistema,[3] entre uno de estos estados de equilibrio intermedio y el sucesivo es una variación infinitesimal, es decir, la diferencia que hay entre el valor de una de las variables en un estado y el siguiente es un infinitésimo.
Un proceso reversible es aquel en que se puede hacer que el sistema vuelva a su estado original, sin variación neta del sistema ni del medio exterior.
Reversibilidad
editarLa reversibilidad es la capacidad de un sistema termodinámico macroscópico de experimentar cambios de estado físico, sin un aumento de la entropía, resultando posible volver al estado inicial cambiando las condiciones que provocaron dichos cambios.
Una definición más fácil puede ser la capacidad de un objeto para volver a su estado original.
Un ejemplo típico de reversibilidad es el que se da en los materiales elásticos que pueden variar su estado de deformación y tensión bajo la acción de ciertas fuerzas y volver a su estado inicial cuando las fuerzas dejan de actuar sobre el material.
Una reacción química puede ser reversible, si es posible que ocurra en ambos sentidos: A <==> B + C.
Ejemplos de reversibilidad
editarEjemplos de elasticidad:
- Estirar un resorte una longitud corta (luego se recupera la forma del resorte)
- Estirar un hule una longitud corta y tiempo corto (luego se recupera la forma del hule)
Otros ejemplos:
- Movimiento sin fricción
- Compresión o expansión restringida.
- Transferencia de energía como calor debido diferencia infinitesimal de la temperatura
- Corriente eléctrica a través de una resistencia cero
- Reacción química restringida
- Mezcla de dos muestras de la misma sustancia en el mismo estado.
Ejemplos de irreversibilidad
editar- Estirar un muelle más allá de su límite elástico.
- Imantar un material ferromagnético.
Véase también
editarReferencias
editar- ↑ La condición de estado de equilibrio termodinámico implica que se den simultáneamente tres situaciones: equilibrio químico, equilibrio térmico y equilibrio mecánico. Se afirma que un sistema está en equilibrio químico y equilibrio térmico cuando tanto su composición química como su temperatura, se manifiestan estables durante un período de tiempo, prudencialmente, largo. Un sistema está en equilibrio mecánico cuando no hay movimientos macroscópicos en el interior del sistema ni de la superficie de separación con el medio exterior. Un estado de equilibrio es, por tanto, un estado de reposo. Hay que hacer notar que, a pesar del nombre, la es una ciencia estática ya que en ella el tiempo no interviene como variable
- ↑ Usando una terminología análoga a la usada en el contexto informático podría decirse que son procesos virtuales, esto es, procesos que sólo pueden darse en unas condiciones modelizadas, propias de un modelo matemático o numérico, pero muy alejadas del mundo real
- ↑ Se refiere a variables macroscópicas del tipo: presión (P), temperatura (T), volumen (V), composición (n)