Pirrolizidina
La pirrolizidina es un alcaloide que se encuentra en la naturaleza, generalmente en muchas de las plantas de las familias Boraginaceae, Compositae y Leguminosae. El alcaloide pirrolizidina es hepatotóxico, es decir, puede dañar el hígado.
| Pirrolizidina | ||
|---|---|---|
| General | ||
| Fórmula estructural |
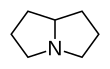 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 643-20-9[1] | |
| ChEBI | 64950 | |
| ChemSpider | 12039 | |
| PubChem | 12558 | |
| UNII | U81KWZ2JKN | |
| Propiedades físicas | ||
| Masa molar | 111,105 g/mol | |
Introducción
Los alcaloides de la pirrolizidina (AP) son toxinas naturales que las plantas sintetizan en su metabolismo secundario como mecanismo de defensa frente a herbívoros. Se han descrito unos 600 AP diferentes en multitud de plantas, la gran mayoría de los cuales pertenecen a 5 familias botánicas, que producen distintos tipos de alcaloides: Asteraceae, Fabeaceae, Boraginaceae, Orchidaceae y Apogynaceae.2
A partir de estas familias, se producen distintos AP, entre los cuales destacan los de tipo senecionina, licopsamina, heliotrina y monocrotalina por su presencia en alimentos y piensos de origen vegetal.1
La estructura básica es el anillo de pirrolizidina, conformado por dos anillos pirrol fusionados con un átomo de nitrógeno como puente. Suelen ser ésteres formados por una estructura que se conoce con el nombre de “necina base” y una parte ácida que se denomina “ácido nécico”.
Existen 4 bases nécicas: retronecina, heliotridina, otonecina y platinecina.
Tienen un doble enlace en la posición 1 y 2 del anillo, una esterificación del hidroximetil de la posición 1 y el hidroxilo en la posición 7 y cadenas alquílicas que esterifican los grupos mencionados. Estas cadenas alquílicas presentan ramificaciones, que facilitan que, una vez ingerido, el anillo de pirrolizidina se descomponga en anillos pirroles de alta reactividad, dando lugar a la toxicidad. 1 y 2
Actividad biológica
El nivel de toxicidad depende fundamentalmente de su estructura química, las rutas individualizadas en el metabolismo de los alcaloides, la tasa de desintoxicación y las variaciones de cada individuo. Para que sean tóxicos es necesario que presenten un doble enlace entre las posiciones 1 y 2 y un grupo éster en la posición C-7, en la posición C-9 o en ambas posiciones de la base de necina.
Los alcaloides de pirrolizidina se consideran pretoxinas, por lo que para producir la toxicidad deben ser activados por el metabolismo hepático a través del mecanismo de detoxificación oxidativa. De esta manera, los alcaloides, ingeridos en su forma terciaria, se transforman en metabolitos pirrólicos gracias a la enzima citocromo P450 monooxigenasa. Además, cuando se consumen en su forma no tóxica, es decir, en forma de N-óxidos y no de base libre o alcaloide terciario (forma tóxica) también pueden reducirse a su alcaloide terciario (forma tóxica), absorberse y posteriormente activarse vía hepática.1
Efectos tóxicos
· A nivel neuronal, son capaces de interrumpir la neurotransmisión al afectar a receptores neuronales, a canales iónicos y a las enzimas encargadas de la degradación de neurotransmisores y segundos mensajeros.
· Detienen la síntesis de proteínas al intercalarse en el ADN.
· Alteran el metabolismo de los hidratos de carbono por la inhibición de enzimas involucradas en este proceso.
Los efectos derivados de estos mecanismos de toxicidad se manifiestan en forma de daño hepático y pulmonar, especialmente con la aparición de enfermedad venooclusiva hepática (HVOD).
Además, como consecuencia de su acción sobre el ADN, muchos de los AP se han clasificado como carcinógenos para el ser humano, sobre todo lasiocarpina, monocrotalina y fidelina.6
Ensayos realizados
Se ha realizado un estudio sobre Drosophila melanogaster con dos alcaloides de pirrolizidina (senecifilina y senquirquina) que se encuentran en piensos para animales.
Mediante la prueba BASC, consistente en la alimentación durante 3 días, se estudió la mutagenicidad de estos AP en varias concentraciones diferentes. La mutagenicidad se evaluó mediante la prueba SLRL (sex-linked recessive lethal), que detecta la frecuencia de aparición de mutaciones letales recesivas ligadas al sexo en la línea germinal del insecto.
Se observó que la senecifilina era mutagénica en concentraciones de 10-5, 10-4 y 10-3 M, produciendo un 3,8% de las mutaciones letales (983 cromosomas analizados).
La senquirquina demostró mutagenicidad en concentraciones de 10-5 M, produciendo un 4,4% de mutaciones letales en 2541 cromosomas analizados, frente a un 0,17% en los controles.3 y 4
Además, se realizó un análisis sobre moscas alimentadas con leche de ratas lactantes que recibieron una dosis oral de 25 mg de senecifilina/kg, lo que mostró un 1,2% de mutaciones letales (1477 cromosomas analizados), frente al 0,3% (1533 cromosomas analizados) en los controles.5
Riesgos para la salud humana
La Autoridad Europea de Seguridad Alimentaria (EFSA) ha emitido varias alertas sobre la presencia de AP indeseables en alimentación.
Piensos y tejidos animales: En el 2007, la EFSA emitió una primera opinión científica sobre los alcaloides de pirrolidina desde el punto de vista de sustancias indeseables en alimentación animal. Los alcaloides pirrolizidínicos se transfieren de los piensos a los tejidos animales, lo que implica su presencia en alimentos de origen animal.
Sólo entre un 0,04 y 0,08% de la dosis ingerida se excreta por la leche. Se concluyó que la exposición causada por alimentos derivados de animales alimentados con piensos con contenido de AP era baja.2
Miel: Las abejas producen miel a partir del néctar de las flores. En algunas ocasiones, la miel contiene compuestos que las plantas generan como mecanismos de defensa en respuesta a factores de estrés bióticos y abióticos. Uno de esos compuestos son los alcaloides pirrolizidínicos, que son metabolitos secundarios que las plantas utilizan para protegerse de animales herbívoros, insectos y algunos microorganismos. La OMS recomienda reducir la contaminación de alimentos por alcaloides pirrolizidínicos al menor nivel posible, así como monitorizar mieles que se producen en regiones donde se conoce que existe el riesgo de contaminación con alcaloides pirrolizidínicos. Sin embargo, a la fecha no existe una regulación para la presencia de estos alcaloides en la miel, ya que no se han determinado los límites par establecer los criterios de aceptación o rechazo en la comercialización de este alimento. 1
La presencia de alcaloides pirrolizidínicos en la miel ha sido documentada en estudios de varios países. Por ejemplo, en uno de Estados Unidps se encontró que la miel que se obtuvo de la planta Senecio jacobea presentó una concentración de hasta 3,9µg/g de este tipo de alcaloides. Otro caso fue en Alemania donde se realizó un estudio en el que se incluyeron 216 muestras de mieles que se obtuvieron de supermercados europeos y de estas, 19 tenían alcaloides pirrolizidínicos. 1
Hierbas medicinales e infusiones: La intoxicación aguda por la presencia en estas de los alcaloides pirrolizidínicos deriva en la enfermedad venooclusiva hepática aguda (2mg/kg/día) y la intoxicación crónica se caracteriza por la aparición de cirrosis hepática (durante 6 meses 15 mg/kg/día).2
Enlaces externos
editar- Subhuti Dharmananda. «Safety issues affecting herbs: pyrrolizidine alkaloids». Institute for Traditional Medicine, Portland, Oregon.
- U.S. Food and Drug Administration. Pyrrolizidine Alkaloids
- 1. Yavarik L, García-Figueroa C, Ramírez FJ, Arechavaleta-Velasco M. Presencia de alcaloides pirrolizidínicos en miel y los efectos de su consumo en humanos y abejas. Rev Mex Cienc Pecu 2022;13(3):787-802.
- 2. Alcaloides de la pirrolizidina. Toxinas naturales en plantas. Gencat 2020;15:1-5
- 3. Clark AM. The mutagenic activity of some pyrrolizidine alkaloids in Drosophila. Z Vererbungslehre 1960;91:74–80
- 4. Frei H, Lüthy J, Brauchli J, Zweifel U, Würgler FE, Schlatter C. Structure/activity relationships of the genotoxic potencies of sixteen pyrrolizidine alkaloids assayed for the induction of somatic mutation and recombination in wing cells of Drosophila melanogaster. Chem-Biol Inter 1992;83:1–22.
- 5. Chan PC, Haseman JK, Prejean JD, Nyska A. Toxicity and carcinogenicity of riddelliine in rats and mice. Toxicol Lett 2003;144:295-311.
- 6. Hartmann T. Plant-derived secondary metabolites as defensive chemicals in herbivorous insects: a case study in chemical ecology. Planta. 2004 May;219(1):1-4. doi: 10.1007/s00425-004-1249-y. Epub 2004 Mar 20. PMID: 15042370.