Hipodamina
La hipodamina es un pseudoalcaloide tricíclico aislado de las secreciones defensivas de varias especies de insectos de la familia Coccinellidae: Hippodamia convergens, Hippodamia caseyi, Anisosticta 19-punctata y Chauliognathus pulchellus.[2][3]
| Hipodamina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| (2α,3aα,6aβ,9aβ)(3aS,9aS)-Dodecahidro-2-metilpirido[2,1,6-de]quinolizina | ||
| General | ||
| Fórmula estructural |
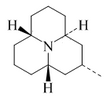 | |
| Fórmula molecular | C13H23N | |
| Identificadores | ||
| Número CAS | 53990-36-6[1] | |
| Propiedades físicas | ||
| Apariencia | Aceite | |
| Masa molar | 193,331 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||

Biosíntesis
editarSe ha comprobado con pruebas de marcaje isotópico que la lisina no participa en la biosíntesis de la hipodamina, sino que ésta se forma por la acción de un ácido graso previamente oxidado[4][5]
:
Derivados
editar| Nombre | Estructura | Fórmula molecular | CAS | Masa molecular (g/mol) | Estado | Fuente natural |
|---|---|---|---|---|---|---|
| Convergina | C13H23NO | 41701-36-4 | 209.331 | Líquido oleoso. | Aislado de secreciones defensivas de Hippodamia convergens e Hippodamia caseyi | |
| Precoccinelina | C13H23N | 38211-56-2 | 193.331 | PF = 195 - 197 °C | Aislado de las secreciones defensivas de Coccinella transversoguttata, Coccinella septempunctata, Chauliognathus pulchellus e Hippodamia convergens[6] | |
| Coccinellina | C13H23NO | 34290-97-6 | 209.331 | Sólido cristalino (Acetona). Descompone a 204 °C | Aislado de las secreciones defensivas de Coccinella transversoguttata y Coccinella septempunctata[7] | |
| Mirrina | C13H23N | 58207-39-9 | 193.331 | Sólido amorfo | Aislado de la secreción defensiva de Myrrha octodecimguttata[8] |
Síntesis
editarLa síntesis de la coccinelina, precoccinelina e hipodamina fue realizada por Aleksey de acuerdo al siguiente esquema sintético. Dado que la hipodamina y la precoccinelina son estereoisómeros, el procedimiento sintético es similar y produce una mezcla de ambos compuestos, los cuales se separan por resolución.[9]
Referencias
editar- ↑ Número CAS
- ↑ Tursch, B. et al., Tet. Lett., 1974, 409
- ↑ Mueller, R.M. et al., JOC, 1984, 49, 2217
- ↑ Haulotte et al. Eur. J. Org. Chem. 2012, 1907–1912
- ↑ Laurent, P. et al., Insect Biochem. Mol. Biol., 2002, 32, 1017- 1023
- ↑ Karlsson, R. et al., Chem. Comm., 1972, 626
- ↑ Ayer, W.A. et al., Can. J. Chem., 1976, 54, 473; 1807; 1976, 54, 1494
- ↑ Tursch, B. et al., Tetrahedron, 1975, 31, 1541
- ↑ Aleksey et al., Org. Lett. (2006) 8(21):4899 - 4902