Encefalopatía espongiforme bovina
La encefalopatía espongiforme bovina (también, popularmente, la enfermedad de las vacas locas o enfermedad de la vaca loca) es una enfermedad causada por priones, y que se puede transmitir a los seres humanos a través del consumo de partes de animales infectados, sobre todo tejidos nerviosos.[1]
| Encefalopatía espongiforme bovina | ||
|---|---|---|
 | ||
| Especialidad |
neurología veterinaria medicina epidemiología patología patogénesis | |
| Sinónimos | ||
| ||
La encefalopatía espongiforme bovina (EEB) o enfermedad de las vacas locas es una enfermedad que pertenece a una misteriosa familia de enfermedades emparentadas, muy raras en su mayoría. Los primeros casos de animales enfermos se declararon en el Reino Unido en 1986.[1] En 1996 se detectó en el ser humano una nueva enfermedad, una variante de la enfermedad de Creutzfeldt-Jakob, que se relacionó con la epidemia de EEB en el ganado vacuno.[cita requerida]
Signos y síntomas
editarLos síntomas no se observan inmediatamente en el ganado debido al período de incubación extremadamente largo de la enfermedad.[2] Se ha observado que algunos bovinos tienen un modo de andar anormal, cambios en el comportamiento, temblores e hiperactividad ante ciertos estímulos.[3] La ataxia de la extremidad trasera afecta la marcha del animal y ocurre cuando se pierde el control muscular. Esto da como resultado un equilibrio y una coordinación pobres.[4] Los cambios de comportamiento pueden incluir agresión, nerviosismo, y un cambio general en el temperamento. Algunos síntomas neurológicos son la marcha irregular y la lamedura persistente. Además, también se han observado síntomas inespecíficos que incluyen pérdida de peso, disminución de la producción de leche, cojera, infecciones del oído y rechinamiento de los dientes debido al dolor. Algunos animales pueden mostrar una combinación de estos síntomas, mientras que otros solo muestran uno de los muchos reportados. Una vez que surgen los síntomas clínicos, generalmente empeoran durante las siguientes semanas y meses, lo que finalmente conduce a la recumbencia, el coma y la muerte.[3]
Diagnóstico
editarEl diagnóstico de EEB sigue siendo un problema práctico. Tiene un período de incubación de meses a años, durante el cual no se notan síntomas, aunque se ha iniciado la vía para convertir la proteína prion cerebral normal (PrP) en la forma de PrPSc tóxica relacionada con la enfermedad. En la actualidad, prácticamente no se conoce ninguna forma de detectar PrPSc de manera confiable excepto mediante el examen del tejido cerebral post mortem usando métodos neuropatológicos e inmunohistoquímicos. La acumulación de PrPSc en forma de PrP anormalmente plegada es una característica de la enfermedad, pero está presente a niveles muy bajos en fluidos corporales fácilmente accesibles tales como sangre u orina. Los investigadores han intentado desarrollar métodos para medir PrPSc que no se han aceptado completamente para su uso en materiales como la sangre.
El método tradicional de diagnóstico se basa en el examen histopatológico de la médula oblonga del cerebro y otros tejidos, post mortem. La inmunohistoquímica puede usarse para demostrar la acumulación de proteína priónica.[5]
En 2010, un equipo de Nueva York describió la detección de PrPSc incluso cuando inicialmente estaba presente en solo una parte en cien mil millones (10-11) en tejido cerebral. El método combina la amplificación con una nueva tecnología llamada inmunoensayo de fibra óptica envolvente y algunos anticuerpos específicos contra PrPSc. Después de amplificar y luego concentrar cualquier PrPSc, las muestras se etiquetan con un colorante fluorescente usando un anticuerpo para especificidad y luego se cargan en un tubo microcapilar. Este tubo se coloca en un aparato especialmente construido, totalmente rodeado de fibras ópticas para capturar toda la luz emitida una vez que el tinte se excita utilizando un láser. La técnica permitió la detección de PrPSc después de muchos menos ciclos de conversión que otros lograron, reduciendo sustancialmente la posibilidad de artefactos, así como la aceleración del ensayo. Los investigadores también probaron su método en muestras de sangre de ovejas aparentemente sanas que desarrollaron tembladera. Los cerebros de los animales se analizaron una vez que los síntomas se hicieron evidentes. Los investigadores podrían, por lo tanto, comparar los resultados del tejido cerebral y la sangre tomada una vez que los animales exhibieron los síntomas de las enfermedades, con sangre obtenida antes en la vida de los animales, y de animales no infectados. Los resultados mostraron muy claramente que PrPSc podría detectarse en la sangre de los animales mucho antes de que aparecieran los síntomas. Después de un mayor desarrollo y pruebas, este método podría ser de gran valor en la vigilancia como una prueba de detección basada en sangre u orina para la EEB.[6][7][1]
Datos científicos
editarEs una enfermedad degenerativa del sistema nervioso central de los bovinos, que se caracteriza por la aparición de síntomas nerviosos en los animales adultos que, progresivamente, finaliza con la muerte del animal.
La enfermedad está causada por una proteína que ha modificado su estructura tridimensional (en Bioquímica, se denominan estructuras secundaria y terciarias de las proteínas), debido a un proceso denominado cambio conformacional, y que las convierte en un agente patológico. Estas proteínas infecciosas se denominan priones.[1] El periodo de incubación de la enfermedad es de 4 o 5 años. Esta proteína es la Prp, que en su variante normal (conformación Nativa) es c, pero al entrar en contacto con la proteína en la conformación no nativa pasa a ser Prp (Sc) y en cadena. Esta, al entrar en contacto con la proteína normal (c) del organismo le induce un cambio conformacional y provoca el paso a la Sc. Es una proteína fisiológica y no se ha podido eliminar del organismo.
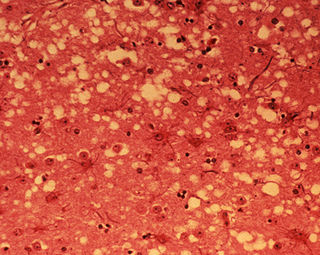
Los síntomas que se observan están motivados por la acumulación del prion en las células neuronales originando la muerte celular. Un análisis microscópico revela lesiones como vacuolas que dan al tejido nervioso un aspecto de esponja.
La vía de transmisión de esta enfermedad conocida hasta la fecha es la ingestión de alimentos contaminados con el prion, la administración de fármacos de origen bovino y provenientes de animales enfermos (típicamente hormona del crecimiento) y posiblemente de madre a hijo. El único método disponible para detectar la infección en fase terminal es la inoculación parenteral de tejido encefálico en ratones. No obstante, esta técnica no es utilizable en la práctica ya que los períodos de incubación son de unos 300 días.
La enfermedad se acumula sobre todo en el cráneo (incluidos encéfalo y ojos), la amígdala, la médula espinal, el intestino (del duodeno al recto) y el bazo.
Alan Colchester de la Universidad de Kent propuso en septiembre de 2005 en la revista médica The Lancet que la enfermedad pudo haberse originado a través de alimento para ganado procedente de la India, contaminado con restos humanos.[8] El gobierno de la India lo negó rotundamente, calificando a la investigación de "engañosa, maliciosa; producto de la imaginación; absurda," añadiendo que la India mantiene controles constantes y que no han tenido ningún caso de EEB o vECJ.[9][10] La mayoría de los científicos piensan que la enfermedad se originó en los propios animales y en el consumo de restos no humanos.
Se cree que el ganado se infectó al ser alimentado con harina de carne y huesos que contenía restos de otro ganado que desarrolló espontáneamente la enfermedad o por productos de ganado ovino y caprino (que ya presentaban la enfermedad, pero no se trasmitía a humanos, denominada scrapie), lo que conllevó a que en 1998 en Reino Unido se sacrificaran e incineraran a los animales sospechosos de haber adquirido la enfermedad.
Patogenesia
editarLa patogénesis de la EEB no se entiende bien ni se documenta como otras enfermedades de esta naturaleza. A pesar de que la EEB es una enfermedad que produce defectos neurológicos, su patogénesis ocurre en áreas que residen fuera del sistema nervioso.[11] Hubo una fuerte deposición de PrPSc inicialmente localizada en las placas de Peyer del intestino delgado.[12] El sistema linfático ha sido identificado en la patogénesis de los recortes. Sin embargo, no se ha determinado que sea una parte esencial de la patogénesis de la EEB. Las placas de Peyer han sido el único órgano de este sistema que se ha encontrado que desempeña un papel importante en la patogénesis. La infecacia de las placas de Peyer se ha observado a los 4 meses de la inoculación. Se encontró que la acumulación de PrPSc ocurre principalmente en macrófagos corporales tangibles de las placas de Peyer. Se cree que los macrófagos corporales tangibles implicados en la eliminación de PrPSc juegan un papel en la acumulación de PrPSc en dichas placas de Peyer. La acumulación de PrPSc también se encontró en células dendríticas foliculares aunque en menor grado.[13] Seis meses después de la inoculación, no se observó infectividad en ningún tejido, salvo en el íleon. Esto llevó a los investigadores a creer que el agente de la enfermedad se reproduce aquí. En casos naturalmente confirmados, no ha habido informes de infectividad en las placas de Peyer. Generalmente, en experimentos clínicos, se administran altas dosis del patógeno. En casos naturales, se formuló la hipótesis de que estaban presentes dosis bajas del agente y, por lo tanto, no se pudo observar la infectividad.[14]
Incidencia
editarLa encefalopatía espongiforme bovina llegó a España en el año 2000 cuando se detectó en una vaca. En 2001 llegó a la cumbre provocando una crisis sanitaria que sería controlada un año más tarde gracias al control europeo de la epidemia. En el año 2000 se detecta el primer caso de EEB en España, Carballedo (Lugo), seguido de la creación de una Comisión Interministerial de Seguridad Alimentaria acompañado de una serie de medidas para la destrucción masiva de materiales específicos de riesgo, El 22 de diciembre se aprueba un plan de medidas contra la EEB con un coste de 60 millones de pesetas. Los vecinos de Mesía (La Coruña) pasan la Nochevieja concentrados en la entrada de un mina protestando por el entierro de vacas. El uno de enero de 2001 entró en vigor la obligación de hacer pruebas EEB a los bovinos mayores de 30 meses que se dirigieran al consumo y la prohibición de las harinas animales para la alimentación del ganado. El 16 de enero se crea el Comité Especial sobre la Encefalopatía Espongiforme Transmisible. El 31 de marzo entra en vigor la norma europea que ordena la retirada de la cadena alimentaria del espinazo de los bovinos de más de un año, que se une a la lista de Materiales Específicos de Riesgo junto con el cerebro, médula espinal, intestinos, ojos y amígdalas. El 28 de abril España levanta el embargo vacuno procedente de Francia e Irlanda. El 3 de enero de 2002 entra en vigor una ley que establece multas hasta el 1,2 millones de euros para el infractor en materia de encefalopatías espongiformes transmisibles. En 2003 se confirma un caso en Canarias, que afecta las demás comunidades autónomas. En 2005 muere una mujer de 26 años. En 2007 el Ministerio Agricultura y Ganadería reporta en España un total 713 casos de "vacas locas" desde que se tuvo constancia del primero.[15]
Hasta 2007, inclusive, se declararon 336.799 reses enfermas de EEB en la Unión Europea y 516 más en el resto del mundo,[16] la inmensa mayoría en el Reino Unido: el 98,38%. Solo en Gran Bretaña fueron sacrificadas más de 2 millones de reses.
Por otra parte, hasta junio de 2010 se diagnosticaron 220 pacientes humanos afectados por la nueva variante de la Enfermedad de Creutzfeldt-Jakob, 217 casos primarios y 3 secundarios (por una transfusión de sangre).[17]
El 18 de octubre de 2018 el gobierno de Escocia confirmó la identificación de un caso de EEB en una granja de Aberdeenshire.[18]
Véase también
editarReferencias
editar- ↑ a b c d Levine, Joseph S. (2010). Miller & Levine biología. Pearson. ISBN 0-13-368720-1. OCLC 649855688. Consultado el 19 de mayo de 2022.
- ↑ Thomson, Gavin. "Bovine Spongiform Encephalopathy (BSE)" (PDF). Retrieved November 21, 2016.
- ↑ a b "Bovine Spongiform Encephalopathy" (PDF). The Center for Food Security & Public Health. The Center for Food Security & Public Health. August 2016. Retrieved October 30, 2016.
- ↑ "Ataxias and Cerebellar or Spinocerebellar Degeneration Information Page: National Institute of Neurological Disorders and Stroke (NINDS)". www.ninds.nih.gov. Retrieved 2016-12-01.
- ↑ Bovine Spongiform Encephalopathy reviewed and published by WikiVet. Retrieved 11 October 2011.
- ↑ "Detecting Prions in Blood" (PDF). Microbiology Today.: 195. August 2010. Retrieved 21 August2011.
- ↑ "SOFIA: An Assay Platform for Ultrasensitive Detection of PrPSc in Brain and Blood" (PDF). SUNY Downstate Medical Center. Retrieved 19 August2011.
- ↑ «Mad cow disease and Ganga burials - Mad cow came from human remains fished out from Ganges». Archivado desde el original el 1 de mayo de 2009. Consultado el 2009.
- ↑ India dismisses Lancet's mad cow-India-The Times of India
- ↑ The World Today - New theory traces mad cow disease to animal feed exported from India
- ↑ Espinosa, Juan Carlos; Morales, Mónica; Castilla, Joaquín; Rogers, Mark; Torres, Juan María (2007-01-01). "Progression of prion infectivity in asymptomatic cattle after oral bovine spongiform encephalopathy challenge". Journal of General Virology. 88 (4): 1379–1383. doi:10.1099/vir.0.82647-0.
- ↑ Balkema-Buschmann, A.; Fast, C.; Kaatz, M.; Eiden, M.; Ziegler, U.; McIntyre, L.; Keller, M.; Hills, B.; Groschup, M. H. (2011-11-01). "Pathogenesis of classical and atypical BSE in cattle". Preventive Veterinary Medicine. Special Issue: Animal Health in the 21st Century - A Global ChallengeAnimal Health in the 21st Century. 102 (2): 112–117. doi:10.1016/j.prevetmed.2011.04.006.
- ↑ Hoffmann, Christine; Ziegler, Ute; Buschmann, Anne; Weber, Artur; Kupfer, Leila; Oelschlegel, Anja; Hammerschmidt, Baerbel; Groschup, Martin H. (2007-01-01). "Prions spread via the autonomic nervous system from the gut to the central nervous system in cattle incubating bovine spongiform encephalopathy". Journal of General Virology. 88 (3): 1048–1055. doi:10.1099/vir.0.82186-0.
- ↑ Wells, G; Hawkins, S; Green, R; Austin, A; Dexter, I; Spencer, Y; Chaplin, M; Stack, M; Dawson, M (1998). "Preliminary observations on the pathogenesis of experimental bovine spongiform encephalopathy (BSE): an update" (PDF). The Veterinary Record. 142: 103–106. doi:10.1136/vr.142.5.103.
- ↑ «Ocho años de 'vacas locas' en España». Rtve. 07.04.2008. Consultado el 22 de enero de 2021.
- ↑ https://web.archive.org/web/20100911113104/http://www.eeb.es/pags/europa.htm.
- ↑ https://web.archive.org/web/20120721234746/http://www.cjd.ed.ac.uk/vcjdworld.htm.
- ↑ «Escocia confirma un caso de vaca loca en una granja». Euronews. 18 de octubre de 2018. Consultado el 18 de octubre de 2018.