Isoxazol
El isoxazol es un compuesto heterocíclico de la familia de los azoles, con un átomo de oxígeno al lado del de nitrógeno. También se llama así a toda la clase de compuestos que contienen este anillo. El isoxazolilo es el radical univalente derivado de isoxazol (eliminando uno de los átomos de hidrógeno del anillo se obtiene este radical o grupo funcional).
| Isoxazol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,2-oxazol | ||
| General | ||
| Otros nombres | isoxazol | |
| Fórmula estructural |
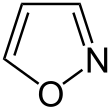 | |
| Fórmula molecular | C3H3NO | |
| Identificadores | ||
| Número CAS | 288-14-2[1] | |
| ChEMBL | CHEMBL13257 | |
| PubChem | 9254 | |
| Propiedades físicas | ||
| Densidad | 1075 kg/m³; 1075 g/cm³ | |
| Masa molar | 6 906 202 g/mol | |
| Punto de ebullición | 95 °C (368 K) | |
| Propiedades químicas | ||
| Acidez | -3,0[2] pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Los anillos de isoxazol se encuentran en algunos productos naturales, tales como el ácido iboténico. Los isoxazoles también forman la base para un montón de fármacos, incluyendo el inhibidor de la COX-2 valdecoxib (Bextra).
Un grupo isoxazolilo se encuentra en muchos antibióticos beta-lactámicos para microorganismos resistentes, tales como cloxacilina, dicloxacilina y flucloxacilina.
El esteroide androgénico sintético danazol también tiene un anillo de isoxazol.
Reactividad
editar- Reacciones con electrófilos: La posición más favorecida es la del C-4, donde se puede dar la recación de sustitución electrófila aromática[3]
- Reacciones con nucleófilos: al poseer un enlace N-O, hace que las reacciones que usan nucleófilos provoquen la ruptura del enlace N-O, originando la ruptura del anillo. Generalmente se inicia la reacción de sustitución nucleófila aromática desprotonando el protón de C-3 para originar un carbanión que evoluciona hacia la formación de un β-oxonitrilo:[3]
La reacción transcurre con excelentes rendimientos y constituye un procedimiento general para introducir un grupo ciano en la posición α de una cetona.
Síntesis
editar- La síntesis clásica del isoxazol es con un compuesto 1,3-dielectrófilo (mejor si es simétrico para evitar problemas de regioselectividad) e hidroxilamina (NH2OH).
Para esta síntesis, el pH juega un papel fundamental. El medio ácido convierte el 1,3-dieletrófilo (un diacetal) en un compuesto 1,3-dicarboxílico, que reacciona con el NH2OH. Además, el pH juega un papel fundamental en la electroafinidad de la molécula de hidroxilamina: en medio básico, pierde un protón y el átomo de oxígeno se vuelve el más nucleófilo; mientras que en medio neutro el más nucleófilo es el átomo de nitrógeno; y en medio ácido se forma una sal de hidroxilamonio (NH3OH+). En la reacción, partimos de la sal clorhidrato de hidroxilamina (NH3OHCl), que al reaccionar con el diacetal se transforma en NH2OH.
- Síntesis por cicloadición 1,3-dipolar:
Se trata de una cicloadición que requiere de un dipolarófilo (en el ejemplo sería el alquino) y un dipolo con heteroátomos (que para isoxazoles se suele usar una nitrona). En la siguiente imagen se esquematiza:[4][5][6]
Bibliografía
editar- ↑ Número CAS
- ↑ Zoltewicz, J. A. & Deady, L. W. Quaternization of heteroaromatic compounds. Quantitative aspects. Adv. Heterocycl. Chem. 22, 71-121 (1978).
- ↑ a b Soto, José Luis (2005). Química Orgánica Vol. III Grupos funcionales y heterociclos. Síntesis. pp. 507-508. ISBN 84-9756-323-9.
- ↑ Jianping Xu, Ashton T. Hamme II (2008). «Efficient Access to Isoxazoles from Alkenes». Synlett 20: 919-923. doi:10.1055/s-2008-1042906.
- ↑ Benjamin Willy, Frank Rominger, Thomas J. J. Müller (2008). «Novel Microwave-Assisted One-Pot Synthesis of Isoxazoles by a Three-Component Coupling-Cycloaddition Sequence». Synthesis 24: 293-303. doi:10.1055/s-2007-1000856.
- ↑ F. Himo, T. Lovell, R. Hilgraf, V. V. Rostovtsev, L. Noodleman, K. B. Sharpless, V. V. Fokin (2005). «Copper(I)-Catalyzed Synthesis of Azoles. DFT Study Predicts Unprecedented Reactivity and Intermediates». J. Am. Chem. Soc. 127: 210-216. doi:10.1021/ja0471525.