Humuleno
Humuleno, también conocido como α-humuleno o α-cariofileno, es un anillo monocíclico de origen natural sesquiterpeno ((C15H24), que es un anillo de 11 miembros, que consiste en 3 unidades isopreno que contienen tres enlaces dobles C = C no conjugados, dos de ellos está triplemente sustituidos y está doblemente sustituidos por terpenoides. Se encontró por primera vez en los aceites esenciales de Humulus lupulus ( lúpulo ), de la que deriva su nombre.[2] El humuleno es un isómero de β-cariofileno , y los dos se encuentran a menudo juntos como una mezcla en muchas plantas aromáticas (ver "Presencia natural" a continuación).
| Humuleno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2,6,6,9-Tetramethyl-1,4-8-cycloundecatriene | ||
| General | ||
| Otros nombres | alpha-Cariofileno; 3,7,10-Humulatrieno | |
| Fórmula estructural |
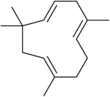 | |
| Fórmula molecular |
C 15H 24 | |
| Identificadores | ||
| Número CAS | 6753-98-6[1] | |
| Número RTECS | GZ4817500 | |
| ChEBI | 5768 | |
| ChEMBL | 251280 | |
| ChemSpider | 4444853 | |
| PubChem | 5281520 | |
| UNII | 54W56MD2WD | |
| KEGG | C09684 | |
|
C\1=C/C(C)(C)C/C=C(/CC/C=C(/C/1)C)C
| ||
| Propiedades físicas | ||
| Apariencia | líquido amarillo verdoso pálido claro | |
| Densidad | 0,886 kg/m³; 0,000886 g/cm³ | |
| Masa molar | 204,35 g/mol | |
| Punto de fusión | 25 °C (298 K) | |
| Punto de ebullición | 106 °C (379 K) | |
| Riesgos | ||
| LD50 | >48 mg/kg | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Preparación y síntesis
editarHumuleno es uno de los muchos sesquiterpenoides que se derivan de difosfato de farnesilo (FPP). La biosíntesis comienza con la pérdida de difosfato de FPP bajo la acción de las enzimas de síntesis de sesquiterpeno, generando un catión alílico que es altamente susceptible a ataques intramoleculares.[3]
Esta biosíntesis puede ser imitado en el laboratorio mediante la preparación stanane alílico de farnesol, denominada síntesis Corey. Hay diversas formas de sintetizar humuleno en el laboratorio, que implican diferentes cierres del enlace C-C en el macrociclo. La síntesis McMurry utiliza una reacción de acoplamiento catalizando carbonilo de titanio; la síntesis Takahashi utiliza alquilación intramolecular de un haluro de alilo por un anión cianohidrina protegido; la síntesis Suginome utiliza un fragmento de geranilo; y la síntesis de Groot sintetiza humuleno crudo de un destilado de aceite de eucalipto.[4] Humuleno también se puede sintetizar usando una combinación del conjunto de cuatro componentes y la ciclación mediada por paladio, puede describe a continuación. Esta síntesis se destaca por la sencillez de las construcciones de bonos C-C y los pasos de ciclación, que se cree resultará ventajosa en la síntesis de politerpenoides relacionados.[5]
Para entender la regioselectividad del humuleno, el hecho de que uno de los dos dobles enlaces C = C triplemente sustituido es significativamente más reactivo, su espacio conformacional fue explorado computacionalmente y se identificaron cuatro conformaciones diferentes.[6]
Presencia natural
editarHumuleno es uno de los aceites esenciales realizadas en el cono de floración de la planta de lúpulo Humulus lupulus. La concentración de humuleno varía entre diferentes variedades de la planta, pero puede ser de hasta 40% del aceite esencial.[7] El humuleno y sus productos de reacción en el proceso de elaboración de cerveza da a muchas cervezas su aroma "de lúpulo". Algunas variedades se ha encontrado que tienen niveles más altos de humuleno, mientras que otras variedades amargas de lúpulo contienen niveles bajos.[8] Múltiples epóxidos de humuleno se producen en el proceso de elaboración de la cerveza. En un estudio científico realizado por análisis por Cromatografía de Gases / Espectrometría de Masas de muestras y un panel sensorial entrenado, se encontró que los productos de hidrólisis de epóxido humuleno II produce específicamente un aroma "de lúpulo" en la cerveza.[9][10] El humuleno también se encuentra en otras plantas como es el caso del Cannabis.[11]
Otros usos
editar- Bebidas
Además de en la cerveza, el lúpulo también se usa en infusiones de hierbas y en los refrescos. Estos refrescos incluyen Julmust (una bebida carbonatada similar a la soda que es popular en Suecia durante diciembre), Malta (un refresco latinoamericano) y kvas.
- Medicinal
El lúpulo también se utilizan en la medicina herbal de una manera similar a la valeriana, como tratamiento para la ansiedad, inquietud e insomnio.[12] Una almohada llena de lúpulo es un remedio popular para el insomnio, y la investigación en animales ha demostrado un efecto sedante.[13] El efecto relajante del lúpulo puede ser debido, en parte, a la degradación del producto específico de ácidos alfa , 2-metil-3-buten-2-ol, como se demuestra a partir del consumo durante la noche de la cerveza sin alcohol.[14][15] El lúpulo tienden a ser inestable cuando se exponen a la luz o el aire y perder su potencia después de un almacenamiento de unos meses.
El lúpulo es de interés para la terapia de reemplazo hormonal y están bajo la investigación básica para el alivio potencial de problemas relacionados con la menstruación.[16][17]
En la investigación preliminar veterinaria, los compuestos de lúpulos están en estudio para la actividad potencial contra la laminitis asociada en la pastura en caballos.[18]
Referencias
editar- ↑ Número CAS
- ↑ Glenn Tinseth, "Hop Aroma and Flavor", January/February 1993, Brewing Techniques. <http://realbeer.com/hops/aroma.html> Accessed July 21, 2010
- ↑ Moss, G.P., "Humulene derived sesquiterpenoid biosynthesis." International Union of Biochemistry and Molecular Biology Enzyme Nomenclature. Accessed April 10, 2011. http://www.enzyme-database.org/reaction/terp/humul.html
- ↑ Goldsmith, David. "The total synthesis of natural products". Canada: John Wiley & Sons. 1997 pp 129-133
- ↑ Hu, Tao & Corey, E.J. (2002). «Short Syntheses of (±)-δ-Araneosene and Humulene Utilizing a Combination of Four-Component Assembly and Palladium-Mediated Cyclization». Organic Letters 4 (14): 2441-2443. PMID 12098267. doi:10.1021/ol026205p.
- ↑ Neuenschwander, U et al. (2012). «Origin of Regioselectivity in α-Humulene Functionalization». J. Org. Chem 77 (6): 2865-2869. doi:10.1021/jo3000942.
- ↑ Katsiotis, S. T.; Langezaal, C. R.; Scheffe, J. J. C. (1989). Planta Med. 55: 634. doi:10.1055/s-2006-962205.
- ↑ «Copia archivada». Archivado desde el original el 24 de septiembre de 2015. Consultado el 14 de abril de 2015.
- ↑ Yange, Xiaogen; Lederer, Cindy; McDaniel, Mina & Deinzer, Max. (1993). «Evaluation of hydrolysis products of humulene epoxides II and III». Journal of Agricultural and Food Chemistry 41 (8): 1300-1304. doi:10.1021/jf00032a026.
- ↑ Peackock, Val & Deinzer, Max (1981). «Chemistry of hop aroma in beer». Journal of the American Society of Brewing Chemists 39. Archivado desde el original el 30 de diciembre de 2013.
- ↑ Aizpurua-Olaizola, Oier; Soydaner, Umut; Öztürk, Ekin; Schibano, Daniele; Simsir, Yilmaz; Navarro, Patricia; Etxebarria, Nestor; Usobiaga, Aresatz (2 de febrero de 2016). «Evolution of the Cannabinoid and Terpene Content during the Growth of Cannabis sativa Plants from Different Chemotypes». Journal of Natural Products (en inglés). doi:10.1021/acs.jnatprod.5b00949. Consultado el 18 de febrero de 2016.
- ↑ Plants for a Future: Humulus lupulus Plants for a Future. Retrieved 4 September 2012.
- ↑ Franco L, Sánchez C, Bravo R, Rodriguez A, Barriga C, Juánez JC; Sánchez; Bravo; Rodriguez; Barriga; Juánez (junio de 2012). «The sedative effects of hops (Humulus lupulus), a component of beer, on the activity/rest rhythm». Acta Physiologica Hungarica 99 (2): 133-9. PMID 22849837. doi:10.1556/APhysiol.99.2012.2.6.
- ↑ Franco L, Sánchez C, Bravo R, Rodriguez A, Barriga C, Juánez JC (2012). «The sedative effects of hops (Humulus lupulus), a component of beer, on the activity/rest rhythm». Acta Physiol Hung 99 (2): 133-9. PMID 22849837. doi:10.1556/APhysiol.99.2012.2.6.
- ↑ Franco L1, Sánchez C, Bravo R, Rodríguez AB, Barriga C, Romero E, Cubero J (2012). «The sedative effect of non-alcoholic beer in healthy female nurses». PLoS One 7 (7): e37290. PMID 22815680. doi:10.1371/journal.pone.0037290.
- ↑ Bowe J, Li XF, Kinsey-Jones J et al. (noviembre de 2006). «The hop phytoestrogen, 8-prenylnaringenin, reverses the ovariectomy-induced rise in skin temperature in an animal model of menopausal hot flushes». The Journal of Endocrinology 191 (2): 399-405. PMC 1635969. PMID 17088409. doi:10.1677/joe.1.06919.
- ↑ Keiler AM, Zierau O, Kretzschmar G; Zierau; Kretzschmar (mayo de 2013). «Hop extracts and hop substances in treatment of menopausal complaints». Planta Medica 79 (7): 576-9. PMID 23512496. doi:10.1055/s-0032-1328330.
- ↑ «Beer Breakthrough: Hops May Prevent Pasture-Associated Laminitis». Horse Collaborative. 1 de agosto de 2014. Archivado desde el original el 7 de diciembre de 2014. Consultado el 11 de diciembre de 2014.