Fenolftaleína
La fenolftaleína, de fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,2 (incoloro) y pH=10 (magenta o rosado). Sin embargo, en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración: la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna anaranjado.
| Fenolftaleína | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
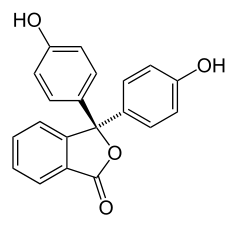
| 3,3-bis(4-hidroxifenil)-2-benzofuran-1(3H)-ona | ||
| General | ||
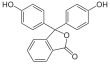
| Fórmula semidesarrollada | C20H14O4 | |
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 77-09-8[1] | |
| ChEBI | 34914 | |
| ChEMBL | CHEMBL63857 | |
| ChemSpider | 4600 | |
| DrugBank | DB04824 | |
| PubChem | 4764 | |
| UNII | 6QK969R2IF | |
| KEGG | D05456 C14286, D05456 | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco | |
| Densidad | 1277 kg/m³; 1,277 g/cm³ | |
| Masa molar | 318,32 g/mol | |
| Punto de fusión | 531 K (258 °C) | |
| Compuestos relacionados | ||
| Indicadores | Rojo de metilo, Azul de timol | |
| Estructura similar | Timolftaleína, Trifenilmetano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Es un compuesto químico orgánico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3) en presencia de ácido sulfúrico.
Farmacología y otros
editarEn farmacología y terapéutica se utiliza como laxante catártico. En México y otros países, a pesar de que se ha limitado su uso como medicamento dada la suposición de que tiene efectos cancerígenos, fue incorporado a la farmacopea homeopática y se sigue vendiendo en las farmacias como especialidad homeopática. En Chile se sigue vendiendo la presentación ética del medicamento.[2]
En análisis clínicos, la fenolftaleína se utiliza como agente de diagnóstico para investigar la función renal y en la determinación de orina residual en la vejiga. Aquí se usa una forma inyectable del fármaco.
Igualmente en microbiología este compuesto químico se utiliza en la forma de difosfato de fenolftaleína para la identificación de bacterias específicas ( positivas para fosfatasa ácida) en algunos medios de cultivo selectivos.
Antecedentes
editarLa acción catártica de la fenolftaleína se descubrió de manera accidental. Hacia finales del siglo XVIII el gobierno de Hungría, para ayudar a que su pueblo pudiera comprar vino barato, decretó que el vino adulterado fuera marcado con fenolftaleína, ya que en presencia de álcali se tornaba rojo brillante y se suponía que era inocuo. Pronto se vio que quienes tomaban la bebida sufrían de diarrea descubriéndose así un nuevo purgante.[3]
Acción
editarLa acción del fármaco es semejante al grupo del antraceno y ejerce un efecto estimulante del peristaltismo intestinal por acción directa sobre las terminaciones nerviosas del colon. Como es un compuesto insoluble en agua pero que forma sales solubles con los álcalis, su acción depende hasta cierto grado de la alcalinidad del tracto gastrointestinal.
Farmacocinética
editarUna dosis terapéutica pasa a través del estómago sin sufrir cambios y se disuelve en el intestino por la acción combinada de las sales biliares y del contenido intestinal alcalino. Cerca de un 15 % se absorbe en la circulación; el resto aparece en las heces sin modificación. Una porción de lo absorbido aparece en la orina, la cual si se vuelve alcalina tendrá una coloración roja, y otra porción se excreta de nuevo al tubo intestinal con la bilis, con lo que de nuevo aumenta la actividad intestinal y sus efectos se siguen notando 3 o 4 días tras su administración inicial. La acción se inicia pasadas 4 u 8 horas tras la administración oral y es eficaz como purgante mostrando poca acción cólica. A finales de los años 1960 e inicios de los 1970 se registraron aproximadamente 28 preparaciones farmacéuticas que contenían como ingrediente principal la fenolftaleína.
Efectos indeseables
editarA dosis elevadas y en personas susceptibles se puede presentar un efecto purgante excesivo, cólico, palpitaciones, respiración alterada y colapso. Se ha registrado un caso fatal por el uso de fenolftaleína[4]
Otras manifestaciones son dermatitis en forma de eritema multiforme o de placas maculares de color rosa que pueden llegar a ser púrpuras. Puede sentirse quemazón y sensación de ardor quemante.
Se han sintetizado derivados de la fenolftaleína pero se encontró que la actividad catártica es mucho menor en aquellos derivados en los que la porción bencénica de la estructura carbonada se alargaba mediante sustitución o cuando la ftalida era reemplazada por ftalamida o por antrona.
Descripción y usos
editarSe presenta normalmente como un polvo blanco que funde a 260 °C. Se utiliza frecuentemente como indicador de pH no extremos, ya que en disoluciones ácidas (no extremadamente muy ácidas) permanece incoloro, pero en presencia de disoluciones básicas (no extremadamente muy básicas) se torna color rosa. En química se utiliza en análisis de laboratorio, investigación y química fina. En análisis químico se usa como indicador de valoraciones ácido-base, siendo su punto de viraje alrededor del valor de pH 9, realizando la transición cromática de incoloro a rosado. El reactivo se prepara al 1 % p/v en alcohol de 90° y tiene duración indefinida.
Otros usos: La fenolftaleína se utiliza como reactivo en la prueba de Kastle-Meyer, para detectar trazas de sangre.
Propiedades químicas
editarLos cambios de color se producen en determinados intervalos de pH, y pueden describirse mediante las siguientes ecuaciones químicas:
De medio neutro a medio básico:
H2Fenolftaleína + 2 OH- ↔ Fenolftaleína2- + 2 H2O
Incoloro → Rosa
De medio básico a medio muy básico:
Fenolftaleína2- + OH- ↔ Fenolftaleína(OH)3-
Rosa → Incoloro
De medio básico a medio neutro o ácido:
Fenolftaleína2- + 2 H+ ↔ H2Fenolftaleína
Rosa → Incoloro
De medio neutro o ácido a medio muy ácido:
H2Fenolftaleína + H+ ↔ H3Fenolftaleína+
Incoloro → Naranja
Así, en disoluciones fuertemente básicas, la fenolftaleína se torna incolora. En disoluciones fuertemente ácidas es naranja. Por lo tanto tiene diferentes intervalos de acción:
| Mecanismos de reacción: H3In+ → H2In → In2− → In(OH)3− |
La fenolftaleína normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa. El cambio de color no puede explicarse solo basándose en la desprotonación, se produce un cambio estructural con la aparición de una tautomería cetoenólica.
Precauciones
editarEn personas con ictericia, la fenolftaleína carece de efecto. No deben tomarla niños menores de dos años. Puede ocurrir idiosincrasia al fármaco.
Presentaciones farmacéuticas
editar- Se puede encontrar en tabletas de 60 mg. Si se presenta de forma amarilla, es una forma menos purificada de la droga.
- Frasco de solución con 50 g.
- Disolución indicadora al 1 por ciento de fenolftaleína.
Referencias
editar- ↑ Número CAS
- ↑ Fenolftaleína en Laboratorio Valma Ltda
- ↑ Farmacología Médica Drill, Sección Catárticos y Laxantes; autor: Desmond D. Bonnycastle.
- ↑ Un Ensayo Clínico de un Laxante de Contacto: Reporte de 250 casos en una Unidad Quirúrgica. Autor: K. T. Chan; Revista Médica de Singapur; pp 83-93, 1962