Fenantridina
La fenantridina es un compuesto heterocíclico de nitrógeno que puede ser descrito como un anillo de piridina fusionado con dos anillos de benceno en los enlaces b y d. También se puede considerar un derivado de reemplazo del carbono 9 del fenantreno por un nitrógeno de imina.[2] Es un polvo color blanco crema, ligeramente soluble en agua.[3]
| Fenantridina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Fenantridina | ||
| General | ||
| Fórmula estructural |
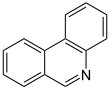 | |
| Fórmula molecular | C13H9N | |
| Identificadores | ||
| Número CAS | [229-87-8][1] | |
| ChEBI | 36421 | |
| ChEMBL | CHEMBL504941 | |
| ChemSpider | 8834 | |
| PubChem | 9189 | |
| UNII | 62QGS7CPS6 | |
| Propiedades físicas | ||
| Densidad | 1126 kg/m³; 1,126 g/cm³ | |
| Masa molar | 179,217 g/mol | |
| Punto de fusión | 107,4 °C (381 K) | |
| Punto de ebullición | 348,9 °C (622 K) | |
| Propiedades químicas | ||
| Acidez | 5.58 pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Aplicaciones
editarLa fenantridina se utiliza en estudios de ecotoxicidad. Es utilizada en investigaciones espectroscópicas rotacionales y búsquedas radioastronómicas. La fenantridina es la base de los colorantes fluorescentes que se unen al ADN mediante intercalación. Ejemplos de tales colorantes son el bromuro de etidio y el yoduro de propidio. La acridina es un isómero de fenantridina.
Reacciones
editarLa nitración de la fenantridina con ácido nítrico en ácido sulfúrico forma el derivado mononitrado en 1 como principal y 2, 3, 4, 5 y 7 como productos secundarios.[4] La bromación se lleva a cabo con N-bromosuccinimida en la posición 2.[5]
Síntesis
editarLa fenantridina fue descubierta por Amé Pictet y H. J. Ankersmit en 1891 por pirólisis del producto de condensación de benzaldehído y anilina.
En el método de síntesis de fenantridinas de Pictet-Hubert (1899), el compuesto se forma en una reacción del aducto 2-aminobifenil-formaldehído (una N-acil-o-xenilamina) con cloruro de zinc a temperaturas elevadas.[6]
Morgan y Walls mejoraron las condiciones de reacción para la reacción de Pictet-Hubert en 1931, reemplazando el metal por oxicloruro de fósforo y usando nitrobenceno como disolvente de reacción. Por esta razón, la reacción también se llama síntesis de fenantridinas de Morgan-Walls .[7]
El método de síntesis es similar a la síntesis de isoquinolinas de Bischler-Napieralski y la Reacción de Pictet-Spengler.
También se han reportado síntesis a partir de cierres por reacciones de Heck intramoleculares.[8]
Chatani y colaboradores han reportado la síntesis de derivados de fenantridina por ciclización oxidativa de 2-isocianobifenilos con ácidos borónicos en un acoplamiento tipo Suzuki. Según sus resultados, la reacción de 2-isocianobifenilos con ácidos borónicos en presencia de acetoacetato de manganeso (III) [Mn(acac)3] produce derivados de fenantridina con altos rendimientos en condiciones relativamente suaves. Han propuesto que esta reacción procede por la sustitución aromática homolítica intramolecular (HAS) a través de un radical radical imidoilo intermedio.[9]
Referencias
editar- ↑ [229-87-8 Número CAS]
- ↑ IUPAC Nomenclature of Organic Chemistry; Recommendations 1993; Appendix; R-9.1 Trivial and semisystematic names retained for naming organic compounds; Table 23 Heterocyclic parent hydrides. [1]
- ↑ Chemical Book - Phenanthridine[2]
- ↑ Caldwell and Walls; J. Chem. Soc., 1952, 2156-2164
- ↑ The Bromination of Phenanthridine. Henry GilmanJohn Eisch. Cite this: J. Am. Chem. Soc. 1955, 77, 23, 6379-6380.
- ↑ Mittheilungen Ueber eine neue Synthese der Phenanthridinbasen Amé Pictet, A. Hubert Berichte der deutschen chemischen Gesellschaft Volume 29 Issue 2, pp. 1182–1189, 1896 doi 10.1002/cber.18960290206
- ↑ Jie Jack Li (ed.), 2004, Name Reactions in Heterocyclic Chemistry, Wiley.
- ↑ F. Rafiee. Applied Organometallic Chemistry. Volume 31, Issue 12, December 2017.Synthesis of phenanthridine and phenanthridinone derivatives based on Pd‐catalyzed C–H activation.
- ↑ M. Tobisu, K. Koh, T. Furukawa, N. Chatani, Angew. Chem. Int. Ed. 2012, 51, 11363