Estilbeno
El estilbeno es un hidrocarburo aromático, de fórmula C14H12, del que existen dos formas isómeras: el trans-1,2-difeniletileno (E-estilbeno) y el cis-1,2-difeniletileno (Z-estilbeno) .
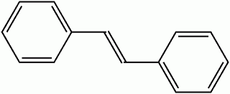  Representación topológica del (E)-estilbeno (arriba) y del (Z)-estilbeno (debajo) | ||
| Nombre IUPAC | ||
| trans-1,2-difeniletileno | ||
| General | ||
| Otros nombres |
| |
| Fórmula molecular | C14H12 | |
| Identificadores | ||
| Número CAS |
103-30-0 (E) 645-49-8 (Z)[1] | |
| ChEBI | 26775 | |
| ChemSpider | 11018 | |
| Propiedades físicas | ||
| Apariencia | Blanco roto | |
| Punto de fusión | 395 K (122 °C) | |
| Punto de ebullición | 579 K (306 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | insoluble | |
| Peligrosidad | ||
| NFPA 704 |
1
1
0
| |
| Frases R | R22 R37 R38 R62 | |
| Frases S | S22 S26 S36 S37 S45 | |
| Riesgos | ||
| Ingestión | nocivo | |
| Inhalación | irritante | |
| Piel | irritante | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Con el mismo término de "estilbenos" se designan también a los derivados hidroxi y alcoxi del estilbeno simple, así como sus formas heterósido (glicósido) y polímeros.
A esta familia pertenecen los polifenoles naturales presentes en muchas familias de plantas superiores (por ejemplo, el trans-resveratrol de la uva).
Junto a los bifenilos y fenantrenos, conforman la familia de los estilbenoides.
El estilbeno es una de las sustancias utilizadas ilegalmente por algunos agricultores, tanto en forma libre como sus derivados (sales o ésteres). Esta sustancia está prohibida en diversos países (Francia.[2]).
Su nombre proviene del griego y significa stilbos, brillante, debido a sus propiedades de fluorescencia.
Descripción
editarEl estilbeno es una molécula, de color amarillo, que existe en dos formas diastereoisómeras, formas (E) y (Z), siendo esta última la menos estable debido a impedimentos estéricos y con un punto de fusión de entre 5 ° y 6 °C, mientras que la forma (E) tiene un punto de fusión de alrededor de 125 °C.
El cis-estilbeno (otro nombre para la forma Z) pueden ser convertidos por fotólisis en su isómero trans-estilbeno (forma E), que posee una fluorescencia azul.
El estilbeno es un disruptor endocrino. Se recomienda, por tanto:
- No comer ni beber durante su uso.
- Almacenarlo en recipientes herméticos.
Estilbenos
editarEsta familia de polifenoles naturales incluye a los derivados hidroxi- y metoxi- del estilbeno simple, así como sus formas glicósido y polímeros. Se encuentran en muchas plantas superiores.
En respuesta a los ataques de agentes patógenos externos (insectos, microorganismos), las plantas se protegen mediante la producción de compuestos tóxicos que contribuyen al bloqueo de los atacantes locales. Algunas de estas sustancias, tales como los alcaloides (nicotina), terpenoides (piretrinas) o isoflavonas (rotenoides) han sido ampliamente estudiados. Otros, como los estilbenos, son mucho menos conocidos.
Los estilbenos permiten comprender por qué algunas variedades de vid son más o menos resistentes a los ataques de hongos. Se ha demostrado[3] que las hojas de la vid inoculadas con el mildiu (Plasmopara viticola) producen estilbenos a nivel local después de unas horas. Estas hojas sintetizan primero resveratrol en grandes cantidades, pero la cantidad de este compuesto puede variar según las variedades de la vid. Para los cultivos susceptibles al mildiu, el resveratrol es glicosilado en un compuesto no tóxico, la piceida, mientras que para variedades resistentes al moho, el resveratrol se oxida en un compuesto tóxico, la viniferina. El resveratrol demostró ser una molécula beneficiosa, no sólo para la planta, sino también para los seres humanos. Estas propiedades terapéuticas han sido numerosas, y siempre atraen un gran número de estudios.[4]
Observaciones similares se realizaron en las coníferas. Un pino sometido al ataque de hongos se defenderá mediante la producción de estilbenos como la pinosilvina,[5] un abeto producirá varios dímeros de glucósidos de estilbeno.[6]
| LOS ESTILBENOS Gluc=O-β-D-glucosilo | ||||||||
| Nombre | Origen | R3 | R4 | R5 | R’3 | R’4 | R’5 | Cadena carbonada |
|---|---|---|---|---|---|---|---|---|
| Pinosilvina | Pinus strobus | H | H | H | OH | H | OH | |
| Piceatanol | Picea abies | OH | H | OH | OH | OH | H | |
| Trans-resveratrol | Uva, cacahuete, Polygonum, Picea |
OH | H | OH | H | OH | H | |
| Trans-pterostilbeno | Pterocarpus, uva | OCH3 | H | OCH3 | H | OH | H | |
| Rapontienina | Vitis | OH | H | OH | H | OCH3 | OH | |
| Isorapontienina | Vitis | OH | H | OH | OCH3 | OH | H | |
| Rapontina, Ponticina | Ruibarbo, Picea abies | Gluc | H | OH | OH | OCH3 | H | |
| Trans-piceida | Uva, ruibarbo, Picea, Polygonum |
Gluc | H | OH | H | OH | H | |
| Astringina | Picea abies | Gluc | H | OH | OH | OH | H | |
Los estilbenos monómeros pueden polimerizarse para dar muchos oligoestilbenos naturales. La mayoría de ellos son polímeros de resveratrol como la (-)-ε-viniferina.
Usos
editar- Los estilbenos se utilizan en la industria de los tintes. Proporcionan los grupos cromóforos de color amarillo o naranja.[7]
- Los estilbenos se emplean como medio de emisión de los láseres de colorante.[8]
- Se emplea como un centelleador cristalino[9] (especialmente en mediciones de coincidencia y de conteo de partículas), con una capacidad de alrededor del 60% la del antraceno (otro cristal orgánico de centelleo). El efecto de la energía de la partícula y el tipo de funcionamiento es similar a la del antraceno. El máximo del espectro de emisión corresponde a una longitud de onda de 410 nm.
Véase también
editarReferencias
editar- ↑ (E)
645-49-8 (Z) Número CAS - ↑ «Decreto de 4 de diciembre de 2008, relativo a la aplicación de la condicionalidad en la relación de 2008». Archivado desde el original el 12 de febrero de 2009. Consultado el 8 de febrero de 2011.
- ↑ R. Pezet, K. Gindro, O. Viret, J.-L. Spring (2004). «Glycosylation and oxidative dimerization of resveratrol are respectively associated to sensitivity and resistance of grapevine cultivars to downy mildew». Physiological and Molecular Plant Pathology (en inglés) 65.
- ↑ Bharat B. Aggarwal (Ed.), Shishir Shishodia (Ed.) (2005). CRC Press, ed. Resveratrol in Health and Disease (en inglés). p. 712.
- ↑ M. S. KEMP, R. S. BURDEN (1986). «PHYTOALEXINS AND STRESS METABOLITES IN THE SAPWOOD OF TREES». Phytochemistry (en inglés) 25 (6).
- ↑ Sheng-Hong Li, Xue-Mei Niu, Stefan Zahn, Jonathan Gershenzon, Jennie Weston, Bernd Schneider (2008). «Diastereomeric stilbene glucoside dimers from the bark of Norway spruce (Picea abies)». Phytochemistry (en inglés) 69: 772-782.
- ↑ «Les colorants alimentaires». Consultado el 7 de febrero de 2010.
- ↑ B. Cagnac, J-P Faroux (2002). «Lasers» (en francés). EDP Sciences, CNRS éditions.
- ↑ Técnico Especialista en Radiodianostico del Servicio Gallego de Salud. Volumen I. Temario de Materias Especificas (Ebook). Editorial MAD-Eduforma. ISBN 8466554874. Pág. 293
