Estado de oxidación
En química, el estado de oxidación (EO) es un indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química (por ejemplo un ión). Formalmente, es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces con elementos distintos fueran 100% iónicos.
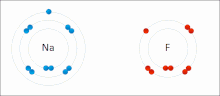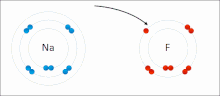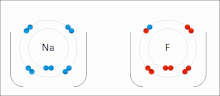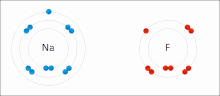
El EO es representado por números, los cuales pueden ser positivos, negativos o cero. En algunos casos, el estado de oxidación promedio de un elemento es una fracción, tal como +8/3 para el hierro en la magnetita (Fe3O4). El mayor EO conocido es +8 para los tetraóxidos de rutenio, xenón, osmio, iridio, hassio y algunos compuestos complejos de plutonio, mientras que el menor EO conocido es -4 para algunos elementos del grupo del carbono (elementos del grupo 14).
Según la normativa de la IUPAC se debe escribir como superíndice del símbolo del elemento químico, indicando primero el número y seguido del signo. Por ejemplo Al3+
La oxidación se da cuando un elemento o compuesto pierde uno o más electrones. Generalmente, cuando una sustancia se oxida (pierde electrones), otra sustancia recibe o capta dichos electrones reduciéndose. Este es el mecanismo básico que promueve las reacciones de óxido-reducción o redox.

Un átomo tiende a obedecer la regla del octeto para así tener una configuración electrónica igual a la de los gases nobles, los cuales son muy estables químicamente (sus átomos no forman enlaces químicos casi con nadie, ni siquiera con ellos mismos). Dicha regla sostiene que un átomo tiende a tener ocho electrones en su nivel de energía más externo. En el caso del hidrógeno este tiende a tener 2 electrones, lo cual le proporcionaría la misma configuración electrónica que la del helio.
Cuando un átomo A necesita, por ejemplo, 3 electrones para obedecer la regla del octeto, entonces dicho átomo tiende a tener un número de oxidación de 3-, cuando adquiera esos 3 electrones. Por otro lado, cuando un átomo B tiene los 3 electrones que deben ser cedidos para que el átomo A cumpla la ley del octeto, entonces este átomo tiende a tener un número de oxidación de 3+, cuando ceda esos 3 electrones. En este ejemplo podemos deducir que los átomos A y B pueden unirse para formar un compuesto, y que esto depende de las interacciones entre ellos. La regla del octeto y del dueto pueden ser satisfechas compartiendo electrones (formando compuestos covalentes, por ejemplo en moléculas como el agua) o cediendo y adquiriendo electrones (formando compuestos iónicos como por ejemplo en los cristales de cloruro de sodio).
Los elementos químicos se dividen en 3 grandes grupos, clasificados por el tipo de carga eléctrica que pueden adquirir al participar en una reacción química:
Existen elementos metálicos que, dependiendo de las condiciones a que sean sometidos, pueden funcionar como metales o no metales indistintamente. A estos elementos se les denomina semimetales o metaloides.
Los elementos metálicos (los cuales tienden a ceder electrones) cuando forman compuestos tienen normalmente estados de oxidación positivos. Los elementos no metálicos y semimetálicos, en cambio, pueden tener estados de oxidación positivos y negativos, dependiendo del compuesto que estén constituyendo.
Definición de la IUPAC
editarLa IUPAC ha publicado una "Definición comprensiva del término estado de oxidación (Recomendaciones IUPAC 2016)" (Comprehensive definition of oxidation state (IUPAC Recommendations 2016)).[1] Es una síntesis de un informe técnico de la IUPAC "Hacia una definición comprensiva del estado de oxidación" ("Toward a comprehensive definition of oxidation state") de 2014.[2] La definición actual de estado de oxidación del Gold Book (Libro de Oro) de la IUPAC es:
Estado de oxidación de un átomo es la carga de este átomo después de la aproximación iónica de sus enlaces heteronucleares....- IUPAC[6]
y el término número de oxidación es casi sinónimo.[3]
El principio subyacente es que la carga iónica es "el estado de oxidación de un átomo, después de la aproximación iónica de sus enlaces",[4] donde aproximación iónica significa, hipotetizando, que todos los enlaces son iónicos. Se consideraron varios criterios para la aproximación iónica:
- Extrapolación de la polaridad del enlace;
- a partir de la diferencia de electronegatividad
- del momento dipolar, y
- de los cálculos cuántico-químicos de las cargas.
- Asignación de electrones según la contribución del átomo al orbital molecular (MO) de enlace[4][5]/ la lealtad del electrón en un modelo Combinación Lineal de Orbitales Atómicos-Orbital molecular (Linear combination of atomic orbitals LCAO-MO)[6]
En un enlace entre dos elementos diferentes, los electrones del enlace se asignan a su principal contribuyente atómico/mayor electronegatividad; en un enlace entre dos átomos del mismo elemento, los electrones se dividen a partes iguales. Esto se debe a que la mayoría de las escalas de electronegatividad dependen del estado de enlace del átomo, lo que hace que la asignación del estado de oxidación sea un argumento un tanto circular. Por ejemplo, algunas escalas pueden dar como resultado estados de oxidación inusuales, como -6 para el platino en PtH2-4, para las escalas de Pauling y Mulliken.[7] Los momentos dipolares, a veces, también darían como resultado números de oxidación anormales, como en el CO y el NO, que están orientados con su extremo positivo hacia el oxígeno. Por lo tanto, esto deja la contribución del átomo a la MO de enlace, la energía atómico-orbital, y de los cálculos cuántico-químicos de las cargas, como los únicos criterios viables con valores convincentes para la aproximación iónica. Sin embargo, para una estimación sencilla de la aproximación iónica, podemos utilizar las electronegatividades de Allen,[4] ya que sólo esa escala de electronegatividad es realmente independiente del estado de oxidación, ya que se relaciona con la energía media de los electrones de valencia del átomo libre según la tabla siguiente de electronegatividades de Allen.
Ejemplos
editar- Cloruro de sodio
2Na0 + Cl02 → 2Na1+ + 2Cl1-
Los gases de un solo tipo de elemento, en este caso el cloro, están presentes en forma diatómica.
El sodio (Na) se combina con el cloro (Cl), produciendo cloruro de sodio. El número de oxidación de ambos elementos sin combinar es 0 (cero), ya que están equilibrados eléctricamente. El número de oxidación del sodio combinado es 1+, ya que cede un electrón. El número de oxidación del cloro combinado es 1-, ya que acepta el electrón cedido por el sodio.
- Óxido de aluminio
Al0 + O02 → Al3+ + 2O2−
El oxígeno (O) está presente en forma diatómica (gas).
El aluminio (Al) se combina con el oxígeno (O), produciendo óxido de aluminio (Al2O3). El número de oxidación de ambos elementos sin combinar es 0 (cero), ya que están equilibrados eléctricamente. El número de oxidación del aluminio combinado es 3+, ya que cede tres electrones. El número de oxidación del oxígeno combinado es 2−, ya que acepta hasta 2 electrones.
Los electrones cedidos y aceptados por los distintos elementos crean un problema con las cargas eléctricas. Por ejemplo, el aluminio cede tres electrones y el oxígeno solo acepta dos, por lo que sobra uno. De esto se concluye que en la reacción no interviene un solo átomo de oxígeno, por lo que se procede a balancear la ecuación, para que coincidan todos los electrones transferidos con las capacidades de cada elemento aceptor.
La ecuación balanceada queda así:
4Al0 + 3O02 → 4Al3+ + 6O2− → 2Al3+ + 3O2−
Con lo que se logra el balance perfecto para que se acomoden todos los electrones excedentes. Los elementos de un elemento libre o en estado basal tienen un número de oxidación igual a 0.
- Todos los elementos metálicos (los cuales ceden electrones) cuando forman compuestos tienen generalmente estados de oxidación positivos.
- Los elementos no metálicos y semimetálicos pueden tener estados de oxidación positivos y negativos, dependiendo del compuesto que estén constituyendo.
- Para cualquier elemento el máximo estados de oxidación es el correspondiente al número de grupo.
- El mínimo estado de oxidación posible de un elemento es 4−, y lo tienen algunos de los elementos del grupo 4A.
- Los no metales tienen un estado de oxidación negativo único, que es igual al número de grupo menos 8.
- Los elementos de los grupos 1A y 2A poseen los estados de oxidación 1+ y 2+ respectivamente.
- El hidrógeno funciona con estado de oxidación 1+ generalmente, a excepción cuando forma hidruros metálicos en donde su estado de oxidación es 1−.
- El número de oxidación del O es 2−, cuando forma peróxidos, donde es 2−, y cuando forma superóxidos, donde es 1−.
- La suma de los estados de oxidación de todos los elementos de un compuesto es igual a su carga neta.
Reglas de los estados de oxidación
editar- El estado de oxidación de todos los elementos en estado libre, no combinados con otros, es de cero (p. ej., Na, Cu, Mg, H2, O2, Cl2, N2).
- El estado de oxidación del H es de +1, excepto en los hidruros metálicos, en los que es de -1 (p. ej., NaH, CaH2).
- El estado de oxidación del O es de -2, excepto en los peróxidos en los que es de -1, en los superóxidos que es -1/2 y en el fluoruro de oxígeno (OF2), donde es de +2.
- El estado de oxidación del elemento metálico de un compuesto iónico es positivo.
- En los compuestos covalentes, el número de oxidación negativo se asigna al átomo más electronegativo y todos los demás son positivos.
- La suma algebraica de los estados de oxidación de los elementos de un compuesto es cero.
- La suma algebraica de los estados de oxidación de los elementos de un ion poliatómico es igual a la carga del ion.[8]
Determinación del estado de oxidación
editarAunque en los niveles introductorios de la enseñanza de la química se utilizan estados de oxidación postulados, la recomendación de la IUPAC[1] y la entrada del Libro de Oro[9] enumeran dos algoritmos totalmente generales para el cálculo de los estados de oxidación de los elementos en compuestos químicos.
Por tanto se pueden utilizar tres maneras de determinar el estado de oxidación:
- El enfoque simple sin consideraciones de enlace (ver más arriba)
- Algoritmos en la recomendación de la IUPAC:
- Algoritmo de asignación de enlaces
Este algoritmo se realiza sobre una estructura de Lewis (un diagrama que muestra todos los electrones de valencia). El estado de oxidación es igual a la carga de un átomo después de que cada uno de sus enlaces heteronucleares se haya asignado a la pareja más electronegativa del enlace (excepto cuando esa pareja es un ligando Lewis-ácido unido reversiblemente) y los enlaces homonucleares se hayan dividido por igual.
- Algoritmo de suma de órdenes de enlaces
Este algoritmo funciona con estructuras de Lewis y gráficos de enlace de sólidos extendidos (no moleculares). El estado de oxidación se obtiene sumando los órdenes de enlace heteronucleares en el átomo como positivo si ese átomo es el socio electropositivo en un enlace particular y como negativo si no lo es, y la carga formal del átomo (si existe) se añade a esa suma.
Uso en nomenclatura
editarEl estado de oxidación en la nomenclatura de compuestos de metales de transición, lantánidos y actínidos se coloca como superíndice a la derecha del símbolo del elemento en una fórmula química, como en FeIII, o entre paréntesis tras el nombre del elemento en los nombres químicos, como hierro(III). Por ejemplo, Fe
2(SO
4)
3 se denomina sulfato de hierro(III) y su fórmula puede mostrarse como FeIII
2(SO
4)
3. Esto se debe a que un ión sulfato tiene una carga de -2, por lo que cada átomo de hierro toma una carga de +3.
Historia del concepto de estado de oxidación
editarPrimeros tiempos
editarLa oxidación propiamente dicha fue estudiada por primera vez por Antoine Lavoisier, quien la definió como el resultado de reacciones con el oxígeno (de ahí su nombre).[10][11] Desde entonces, el término se ha generalizado para implicar una pérdida formal de electrones. Los estados de oxidación, denominados grados de oxidación por Friedrich Wöhler en 1835,[12] fueron uno de los peldaños intelectuales que utilizó Dmitri Mendeléyev para derivar la tabla periódica. William B. Jensen[13] ofrece un resumen de la historia hasta 1938.
Uso en nomenclatura
editarCuando se descubrió que algunos metales formaban dos compuestos binarios diferentes con el mismo no metal, los dos compuestos se distinguían a menudo utilizando la terminación -ico para el estado de oxidación del metal superior y la terminación -oso para el inferior. Por ejemplo, FeCl3 es cloruro férrico y FeCl2 es cloruro ferroso. Este sistema no es muy satisfactorio (aunque a veces se sigue utilizando) porque los distintos metales tienen diferentes estados de oxidación que hay que aprender: férrico y ferroso son +3 y +2 respectivamente, pero cúprico y cuproso son +2 y +1, y estánico y estanoso son +4 y +2. Además, no se tenían en cuenta los metales con más de dos estados de oxidación, como el vanadio, con estados de oxidación +2, +3, +4 y +5.[14]: 84
Este sistema fue sustituido en gran medida por uno sugerido por Alfred Stock en 1919[15] y adoptado[16] por la IUPAC en 1940. Así, FeCl2 se escribe como cloruro de hierro(II) en lugar de cloruro ferroso. El número romano II en el átomo central pasó a denominarse "número de Stock" (término ahora obsoleto), y su valor se obtenía como carga en el átomo central tras eliminar sus ligandos junto con los pares de electrones que compartían con él.[17]: 147
Evolución hacia el concepto actual
editarEl término "estado de oxidación" en la literatura química inglesa fue popularizado por Wendell Mitchell Latimer en su libro de 1938 sobre potenciales electroquímicos.[18] Lo utilizó para el valor (sinónimo del término alemán Wertigkeit) anteriormente denominado "valencia", "valencia polar" o "número polar"[19] en inglés, o "estado de oxidación" o de hecho[20][21] el "estado de oxidación". Desde 1938, el término "estado de oxidación" se relaciona con los potenciales electroquímicos y los electrones intercambiados en las parejas redox que participan en reacciones redox. En 1948, la IUPAC utilizó las reglas de nomenclatura de 1940 con el término "estado de oxidación",[22][23] en lugar de la valencia original.[16] En 1948, Linus Pauling propuso que el número de oxidación podía determinarse extrapolando los enlaces para que fueran completamente iónicos en el sentido de la electronegatividad.[24] La plena aceptación de esta sugerencia se complicó por el hecho de que las electronegatividades de Pauling como tales dependen del estado de oxidación y que pueden dar lugar a valores inusuales de estados de oxidación para algunos metales de transición. En 1990, la IUPAC recurrió a un método postulatorio (basado en reglas) para determinar el estado de oxidación,[25] que se complementó con el término sinónimo número de oxidación como descendiente del número de Stock introducido en 1940 en la nomenclatura. Sin embargo, la terminología que utilizaba "ligandos"[17]: 147 daba la impresión de que el número de oxidación podía ser algo específico de los complejos de coordinación (compuestos químicos formados por un átomo o ion central, generalmente metálico, rodeado por un conjunto de moléculas o iones ligados, denominados ligandos o agentes complejantes). Esta situación y la falta de una verdadera definición única generaron numerosos debates sobre el significado del estado de oxidación, sugerencias sobre métodos para obtenerlo y definiciones del mismo. Para resolver la cuestión, en 2008 se inició un proyecto de la IUPAC (2008-040-1-200) sobre la "Definición exhaustiva del estado de oxidación", que concluyó con dos informes[2][1] y con las entradas revisadas "Estado de oxidación"[9] y "Número de oxidación"[3] en el Libro de Oro de la IUPAC. Los resultados fueron una definición única de estado de oxidación y dos algoritmos para calcularlo en compuestos moleculares y sólidos extendidos, guiados por electronegatividades de Allen que son independientes del estado de oxidación.
Véase también
editarReferencias
editar- ↑ a b c Karen, P.; McArdle, P.; Takats, J. (2016). «Comprehensive definition of oxidation state (IUPAC Recommendations 2016)». Pure Appl. Chem. 88 (8): 831-839. S2CID 99403810. doi:10.1515/pac-2015-1204. hdl:10852/59520.
- ↑ a b Karen, P.; McArdle, P.; Takats, J. (2014). «Toward a comprehensive definition of oxidation state (IUPAC Technical Report)». Pure Appl. Chem. 86 (6): 1017-1081. doi:10.1515/pac-2013-0505.
- ↑ a b Unión Internacional de Química Pura y Aplicada. «Oxidation number». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ a b c Karen, Pavel (2015). «Oxidation State, A Long-Standing Issue!». Angewandte Chemie International Edition 54 (16): 4716-4726. PMC 4506524. PMID 25757151. doi:10.1002/anie.201407561.
- ↑ Hooydonk, G. (1974). O n an Ionic Approximation to Chemical Bonding, Zeitschrift für Naturforschung A, 29(5), 763-767. doi: https://doi.org/10.1515/zna-1974-0517 Archivado el 12 de junio de 2018 en Wayback Machine.
- ↑ «Oxidation state». IUPAC Compendium of Chemical Terminology. 2009. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.O04365.
- ↑ Pure and Applied Chemistry (2014), 86(6), 1017–1081 CODEN: PACHAS; ISSN 0033-4545. English.
- ↑ Nivaldo J. Tro; Whitten, Kenneth J. (2011). Temas Selectos de Química. México, D. F.: Cengage Learning Editores, S.A. p. 205. ISBN 978-607-481-664-8.
- ↑ a b Unión Internacional de Química Pura y Aplicada. «Oxidation state». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ «Antoine Laurent Lavoisier The Chemical Revolution – Landmark – American Chemical Society». American Chemical Society. Archivado desde el original el 5 de enero de 2021. Consultado el 14 de julio de 2018.
- ↑ «Lavoisier on Elements». Chem125-oyc.webspace.yale.edu. Archivado desde el original el 13 de junio de 2020. Consultado el 14 de julio de 2018.
- ↑ Wöhler, F. (1835). Grundriss der Chemie: Unorganische Chemie [Foundations of Chemistry: Inorganic Chemistry]. Berlin: Duncker und Humblot. p. 4.
- ↑ Jensen, W. B. (2007). «the origin of the oxidation-state concept». J. Chem. Educ. 84 (9): 1418-1419. Bibcode:2007JChEd..84.1418J. doi:10.1021/ed084p1418.
- ↑ Petrucci, R. H.; Harwood, W. S.; Herring, F. G. (2002). General Chemistry (8th edición). Prentice-Hall. ISBN 978-0-13-033445-9. (requiere registro).
- ↑ Stock, A. (1919). «Einige Nomenklaturfragen der anorganischen Chemie» [Some nomenclature issues of inorganic chemistry]. Angew. Chem. 32 (98): 373-374. Bibcode:1919AngCh..32..373S. doi:10.1002/ange.19190329802. Archivado desde el original el 6 de agosto de 2020. Consultado el 1 de julio de 2019.
- ↑ a b Jorissen, W. P.; Bassett, H.; Damiens, A.; Fichter, F.; Rémy, H. (1941). «Rules for naming inorganic compounds». J. Am. Chem. Soc. 63: 889-897. doi:10.1021/ja01849a001.
- ↑ a b Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; Hutton, A. T. Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). RSC Publishing. Archivado desde el original el 9 de octubre de 2022.
- ↑ Latimer, W. M. (1938). The Oxidation States of the Elements and their Potentials in Aqueous Solutions (1st edición). Prentice-Hall.
- ↑ Bray, W. C.; Branch, G. E. K. (1913). «Valence and tautomerism». J. Am. Chem. Soc. 35 (10): 1440-1447. doi:10.1021/ja02199a003. Archivado desde el original el 9 de febrero de 2021. Consultado el 16 de septiembre de 2019.
- ↑ Noyes, A. A.; Pitzer, K. S.; Dunn, C. L. (1935). «Argentic salts in acid solution, I. The oxidation and reduction reactions». J. Am. Chem. Soc. 57 (7): 1221-1229. doi:10.1021/ja01310a018.
- ↑ Noyes, A. A.; Pitzer, K. S.; Dunn, C. L. (1935). «Argentic salts in acid solution, II. The oxidation state of argentic salts». J. Am. Chem. Soc. 57 (7): 1229-1237. doi:10.1021/ja01310a019.
- ↑ Fernelius, W. C. (1948). «Some problems of inorganic nomenclature». Chem. Eng. News 26: 161-163. doi:10.1021/cen-v026n003.p161.
- ↑ Fernelius, W. C.; Larsen, E. M.; Marchi, L. E.; Rollinson, C. L. (1948). «Nomenclature of coördination compounds». Chem. Eng. News 26 (8): 520-523. doi:10.1021/cen-v026n008.p520.
- ↑ Pauling, L. (1948). «The modern theory of valency». J. Chem. Soc. 1948: 1461-1467. PMID 18893624. doi:10.1039/JR9480001461. Archivado desde el original el 7 de diciembre de 2021. Consultado el 22 de noviembre de 2021.
|archiveurl=y|archive-url=redundantes (ayuda);|archivedate=y|archive-date=redundantes (ayuda) - ↑ Calvert, J. G. (1990). «IUPAC Recommendation 1990». Pure Appl. Chem. 62: 2204. doi:10.1351/pac199062112167.
Enlaces externos
editar- "Estado de oxidación" — PDF (3.82 KiB) Gold Book de la IUPAC (en inglés)
- "High Oxidation States of 5d Transition Metals" Archivado el 11 de agosto de 2020 en Wayback Machine.
- "Vídeo determinación de los estados de oxidación (práctico)"
- "Vídeo definición del número de oxidación (teórico)"