Equilibrio de Gibbs Donnan
El equilibrio de Gibbs Donnan (así llamado por Josiah Willard Gibbs y Frederick G. Donnan) es el equilibrio que se produce entre los iones que pueden atravesar la membrana y los que no son capaces de hacerlo. Las composiciones en el equilibrio se ven determinadas tanto por las concentraciones de los iones como por sus cargas.
Fundamento
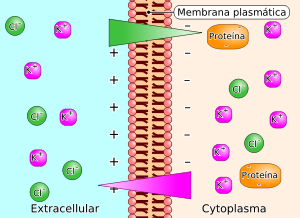
editarCuando partículas de gran tamaño cargadas eléctricamente, como las proteínas, que no se difunden a través de una membrana semipermeable están presentes en un compartimento fluido como el vascular, atraen los iones cargados positivamente y repelen los iones cargados negativamente (tal y como aparece en la figura). Como consecuencia de ello, se establece un gradiente eléctrico y sendos gradientes de concentración de los iones, estos dos últimos iguales y de signo opuesto. En el equilibrio, los productos de las concentraciones iónicas de cada lado de la membrana son iguales. En consecuencia, la concentración de partículas es desigual a ambos lados de la membrana y se establece un gradiente osmótico en dirección hacia el compartimiento que contiene las proteínas. Esta presión osmótica en el equilibrio de Gibbs-Donnan es de unos 6-7 mmHg. El efecto de Donnan sobre la distribución de los iones difusibles es importante en el organismo a causa de la presencia en las células y en el plasma.
Equilibrio de membrana de Donnan
editarEl equilibrio de membrana de Donnan se basa en que a un lado de la membrana hay que "aplicar" una disolución, por ejemplo, cloruro sódico, y al otro lado de la membrana un electrólito cargado negativamente, los iones que son de signo contrario pasan a través de la membrana, y los iones de cloruro y de sodio pasan sin ninguna dificultad por la membrana, los iones de las partículas aniónicas no pasan teniendo un equilibrio a lo largo de la membrana, como existe un equilibrio los volúmenes en la disolución a ambos lados de la membrana son idénticos, la actividad de sal o concentración del cloruro sódico es la misma, por lo tanto, obedece al principio de tendencias de escape:
Sin embargo, no es la única condición que se cumple, debe cumplir la condición de electro neutralidad, esta condición nos dice que:
La concentración de los iones cargados positivamente en las disoluciones, a ambos lados de la membrana tiene que equilibrarse con la concentración de los iones de carga negativa , tal y como aparece a continuación:
En el exterior de la membrana
En el interior de la membrana
siendo R los iones de los electrolitos.
Estas ecuaciones al introducirlas en la primera nos dan como resultado:
La razón de las concentraciones del anión difusible fuera y dentro de la membrana semipermeable depende de la concentración del polielectrolito que con carga negativa se encuentra en el interior del saco semipermeable, tratando de llevar iones de carga similar a la del agua hacia el exterior de la membrana. Cuando es grande comparada con la razón es, aproximadamente, igual a:
Si, por el contrario, es bastante grande con respeto a la razón de la ecuación se hace casi igual a la unidad, y entonces la concentración de la sal es prácticamente la misma a ambos lados de la membrana.
Distribución de la membrana
editarAhora, si la distribución de cargas en la membrana es distinta se produce un potencial en dicha membrana (potencial de donnan) el cual para que este en equilibrio se requiere:
donde dicho índice nos indica que el potencial debe ser una propiedad intensiva del sistema dependiente de la concentración y del potencial eléctrico generado por las cargas.
Dado que el primer coeficiente es diferente de cero, lo que hace que la solución sea continua en todo el plano, entonces despejando la derivada direccional del potencial eléctrico e integrando la ecuación anterior nos resulta:
e integrando para la anterior ecuación se obtiene:
Implicación del equilibrio de Gibbs - Donnan
editarLo que implica que la concentración de cargas dentro y fuera de la membrana debe poseer una estabilidad asociada en cuanto a la concentración de los iones en ambos lados es más si se considerase la membrana semipermeable como un agente catalizador produciría un gradiente de concentración en la membrana y sin embargo el equilibrio sería establecido así:
Bibliografía
editar- Philip, Nelson (2005). Física Biológica, energía, información y vida. Reverté S.A. ISBN 84-291-1837-3.
- Vázquez, J (1992). Biofisica. Eypasa, Madrid.
- Nossal, R.; Lecar, H. (1991). Molecular And Cell Biophysics. Addison-Wesley. Redwood Cyty, CA.