Vitamina C
La vitamina C, enantiómero S del ácido ascórbico o antiescorbútica es un nutriente esencial para el ser humano, los primates, las cobayas y algunos murciélagos, quienes carecen del mecanismo para su síntesis. El resto de los mamíferos lo sintetizan de forma natural en el hígado. Las plantas también producen vitamina C, la cual desempeña un rol importante en su crecimiento y desarrollo. De esta forma, las plantas representan una fuente importante de esta vitamina en la dieta.[1][2][3][4]
| Vitamina C | ||
|---|---|---|
 | ||
 | ||
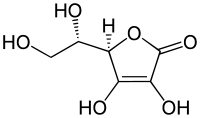
| Nombre (IUPAC) sistemático | ||
| (R)-3,4-dihidroxi-5-((S)-1,2-dihidroxietil)furano-2(5H)-ona | ||
| Identificadores | ||
| Número CAS | 50-81-7 | |
| Código ATC | A11G | |
| PubChem | 644104 | |
| ChEBI | CHEBI:29073 | |
| Datos químicos | ||
| Fórmula | C6H8O6 | |
| Peso mol. | 176,13 g/mol | |
|
C([C@@H]([C@@H]1C(=C(C(=O)O1)O)O)O)O
| ||
|
InChI=1S/C6H8O6/c7-1-2(8)5-3(9)4(10)6(11)12-5/h2,5,7-10H,1H2/t2-,5+/m0/s1
Key: CIWBSHSKHKDKBQ-JLAZNSOCSA-N | ||
| Sinónimos | Vitamina C | |
| Farmacocinética | ||
| Metabolismo | Se oxida en forma reversible a ácido dehidroascórbico | |
| Vida media | 16 días (3,4 horas en personas que tienen niveles muy elevados del compuesto) | |
| Excreción | renal | |
| Datos clínicos | ||
| Estado legal | Uso libre para el público | |
| Vías de adm. | oral | |
La vitamina C es un potente antioxidante soluble en agua que se asocia con varios efectos beneficiosos en el sistema inmune, minimiza y retrasa el proceso de envejecimiento, también beneficia en la integridad endotelial y en el metabolismo de las lipoproteínas. Su deficiencia produce la enfermedad denominada escorbuto.[4][5][6][7][8]
La presencia de esta vitamina es requerida para un alto número de procesos metabólicos en todos los animales y plantas. En los animales, es requerida para el proceso de síntesis de carnitina y colágeno, componentes relevantes de la piel, los tendones, ligamentos, vasos sanguíneos y las cicatrices, por lo que su carencia altera el proceso de reparación y mantenimiento de estas estructuras, así como la curación de las heridas. Así mismo, el ácido ascórbico tiene muchas funciones en las plantas: sirve como tampón de las reacciones de óxido reducción, es cofactor de numerosas enzimas, es el principal antioxidante, regula la división y el crecimiento celular, y está involucrado en la transducción de señales.[4]
La cantidad de vitamina C necesaria para prevenir el escorbuto es de alrededor de 10 mg al día. Sin embargo, con el fin de mantener un sujeto saludable y prevenir afecciones crónicas de salud, las concentraciones disponibles en la dieta deben ser entre 100 y 200 mg al día. La Academia Nacional de Ciencias de Estados Unidos recomienda un consumo mínimo de 90 mg para los hombres y de 75 mg para las mujeres. Debido a la capacidad reducida de almacenamiento de la vitamina C es necesario una permanente y adecuada ingesta para prevenir su hipovitaminosis.[4][9]
Historia
editarEn 1749, James Lind demostró que el consumo de frutas cítricas prevenía o sanaba las afecciones relacionadas con el escorbuto. Debido a esto, al elemento responsable se le denominó «factor antiescorbútico». En 1928, el Dr. Albert Szent-Györgyi aisló el ácido ascórbico, pero no lo identificó como este factor hasta el año 1932. En 1933, identificó su estructura.[4]
En 1937, el Premio Nobel de Química fue concedido a Walter Norman Haworth por su trabajo en la determinación de la estructura del ácido ascórbico, compartido con Paul Karrer, por su trabajo sobre las vitaminas y el premio Nobel de medicina se otorgó a Szent-Györgyi por sus estudios acerca de las funciones biológicas del ácido ascórbico.[10]
Descripción
editarLa vitamina C es una lactona de seis carbonos y es sintetizada a partir de la glucosa almacenada como glucógeno en el hígado de muchas especies de mamíferos. Los seres humanos carecen de la enzima gulonolactona oxidasa necesaria para este proceso.[5]
En animales, el glucógeno hepático se transforma en glucosa-1-fosfato por la acción de la glucógeno fosforilasa; posteriormente, la glucosa-1-fosfato se transforma en UDP-glucosa por acción de la UDP-glucosa pirofosforilasa; luego la UDP-glucosa se transforma en UDP-ácido glucorónico y posteriormente a gulonolactona. La gulonolactona es transformada en ácido ascórbico por acción de la gulonolactona oxidasa.[4][11]
En plantas, el mecanismo de producción de ácido ascórbico es diferente. A partir de la manosa-1-fosfato se genera galactosa, la cual se transforma en l-Galactono-1,4-lactona por acción de la S-galactonolactona deshidrogenasa. La l-Galactono-1,4-lactona es el precursor inmediato del S-ácido ascórbico, por medio de la oxidación catalizada por la l-galactono-1,4-lactona deshidrogenasa. Otra vía de síntesis de la vitamina C en plantas, a partir de ácido galacturónico proveniente de la pectina en frutas maduras, consiste en la reducción del ácido galacturónico por acción de la enzima dependiente de NADPH, ácido galacturónico reductasa (GalUR), dando lugar al l-ácido galactónico el cual se convierte espontáneamente a l-galactono-1,4 lactona.[4]
La glucosa necesaria para producir ascorbato en el hígado (en mamíferos) es extraída del glucógeno, por esto la síntesis de ascorbato es un proceso glicólisis-dependiente. En reptiles y pájaros la biosíntesis es llevada a cabo en los riñones.[11]
Los humanos no poseen la capacidad enzimática de producir vitamina C. La causa de este fenómeno es que la enzima del proceso de síntesis, la S-gulonolactona oxidasa está ausente debido a que el gen para esta enzima (pseudogén ΨGULO) es defectuoso.[12][13][14] La mutación no es letal para el organismo, debido a que la vitamina C es abundante en las fuentes alimentarias. Se ha detectado que las especies con esta mutación (incluyendo humanos) han adaptado un mecanismo de reciclaje para compensarla.[15]
La vitamina C puede absorberse como ácido ascórbico y como ácido dehidroascórbico a nivel de mucosa bucal, estómago y yeyuno (intestino delgado), luego es transportada vía vena porta hacia el hígado para luego ser conducida a los tejidos que la requieran. Se excreta por vía renal (en la orina), bajo la forma de ácido oxálico principalmente, por heces se elimina solamente la vitamina no absorbida.[8]
Se ha observado que la pérdida de la habilidad para sintetizar ascorbato es sorprendentemente paralela a la pérdida evolutiva de la habilidad para reducir ácido úrico. Ácido úrico y ascorbato son fuertes agentes reductores. Esto ha conducido a la sugerencia que en primates superiores, el ácido úrico haya asumido algunas funciones del ascorbato. El ácido ascórbico puede ser oxidado en el cuerpo humano por la enzima acidoascórbico-oxidasa.
Significado biológico
editarLa vitamina C es el S-enantiómero del ascorbato, opuesto al R-enantiómero el cual no tiene utilidad biológica. Cuando el S-ascorbato aplica su potente función reductora es convertido a su forma oxidada, S-dehidroascorbato, que puede ser reducido de nuevo a su forma activa S-ascorbato por acción enzimática del glutatión.
El S-ascorbato es un azúcar ácido débil, estructuralmente relacionado con la glucosa, lo cual ocurre naturalmente, ya que cada uno está unido al ion hidrógeno, formando el ácido ascórbico o un ion metálico del mineral ascorbato.
En humanos, la vitamina C es un potente antioxidante; actuando para disminuir el estrés oxidativo, un substrato para la ascorbato-peroxidasa, así como un cofactor enzimático para la biosíntesis de importantes bioquímicos. Esta vitamina actúa como agente donador de electrones para 8 diferentes enzimas:
- Tres enzimas participan en la hidroxilación del colágeno. Estas reacciones adicionan grupos hidroxilos a los aminoácidos prolina o lisina en la molécula de colágeno (vía prolina-hidroxilasa y lisina-hidroxilasa), con ello permiten que la molécula de colágeno asuma su estructura de triple hélice. De esta manera la vitamina C se convierte en un nutriente esencial para el desarrollo y mantenimiento de tejido de cicatrización, vasos sanguíneos, y cartílago.
- Dos enzimas son necesarias para la síntesis de carnitina. Esta es necesaria para el transporte de ácidos grasos hacia la mitocondria para la generación de ATP.
- Las tres enzimas remanentes tienen funciones en:
- Participación en la biosíntesis de norepinefrina a partir de dopamina, a través de la enzima dopamina-beta-hidroxilasa.
- Otra enzima adiciona grupos amida a hormonas peptídicas, incrementando enormemente su estabilidad.
- Otra modula el metabolismo de la tirosina.
Los tejidos biológicos que acumulan más de 100 veces el nivel sanguíneo de vitamina C, son las glándulas adrenales, hipófisis (pituitaria), timo, cuerpo lúteo, y la retina. Aquellas con 10 a 50 veces la concentración presente en el plasma incluyen el cerebro, bazo, pulmón, testículos, nódulos linfáticos, mucosa del intestino delgado, leucocitos, páncreas, riñón y glándulas salivares. Los glóbulos blancos contienen de 20 a 80 veces más vitamina C que el plasma sanguíneo, y fortalece la capacidad citotóxica de los neutrófilos (glóbulos blancos).
Beneficios de la vitamina C
editar- Evitar el envejecimiento prematuro (proteger el tejido conectivo, la "piel" de los vasos sanguíneos).
- Facilitar la absorción de otras vitaminas y minerales.
- Como antioxidante.
- Evitar las enfermedades degenerativas tales como arteriosclerosis, cáncer, demencia, entre otros.
- Evitar las enfermedades cardíacas (tema tratado más adelante).
- Desde los descubrimientos de Linus Pauling se aseveraba que la vitamina C reforzaba el sistema inmune y prevenía la gripe,[16] pero investigaciones realizadas en los 1990 parecen refutar esta teoría y, en todo caso, han demostrado que el consumo en exceso (a diferencia de lo preconizado por Pauling y sus seguidores) de suplementos de vitamina C son poco recomendables, porque, entre otras cosas, un consumo excesivo puede provocar alteraciones gastrointestinales. No obstante, a diferencia de la vitamina A no tiene efectos tóxicos, ya que al ser hidrosoluble el organismo excreta el exceso de la misma por las vías naturales.
- Tiene un papel fundamental en la formación de colágeno.
- Prevenir escorbuto, polio y hepatitis.
- Disminuir la incidencia de coágulos en las venas.
- Ayudar en los movimientos articulares.
- Acelerar el proceso de curación de heridas, lesiones y quemaduras.
- Se utiliza de forma tópica para eliminar manchas en la piel ya que es un ingrediente activo inhibidor de la tirosinasa, por su propiedad antioxidante y su efecto tensor relacionado con la síntesis de colágeno.
Obtención de vitamina C
editarLa vitamina C se puede obtener de forma natural y sintética.
Las fuentes naturales son el propio ácido ascórbico levógiro (isómero S-) y ascorbato de sodio levógiro, presentes en los distintos alimentos.
De forma sintética puede obtenerse por medio del proceso Reichstein, modificado posteriormente por Kurt Heyns.[17] Sin embargo, la mayor parte de la producción industrial mundial se obtiene por medio de otra modificación más moderna del proceso,[18] desarrollada en China. Ambos procesos utilizan la fermentación con microorganismos, por lo que se obtiene sin problemas el isómero S-.
Uso clínico
editarLa vitamina C es esencial para el desarrollo y mantenimiento del organismo, por lo que su consumo es obligatorio para mantener una buena salud.
La vitamina C ayuda al desarrollo de la absorción del hierro, al crecimiento y reparación del tejido conectivo normal (piel más suave, por la unión de las células que necesitan esta vitamina para unirse), a la producción de colágeno (actuando como cofactor en la hidroxilación de los aminoácidos lisina y prolina), metabolización de grasas y la cicatrización de heridas. También se considera un factor potenciador para el sistema inmune, aunque algunos estudios ponen en duda esta última actividad de la vitamina C.
Para personas con cálculos renales no se recomienda el consumo de suplementos o altas dosis, ya que pueden agravarse los síntomas de la dolencia; esto sucede porque la vitamina C se transforma en oxalato en el cuerpo humano, fomentando en esas personas propensas la litiasis renal por cálculos de oxalato.[19]
Indicaciones
editarEl uso de vitamina C en animales ha demostrado su utilidad en la prevención, acortamiento y alivio de diversas infecciones. Un efecto similar se ha visto en seres humanos, especialmente en el acortamiento y alivio del resfriado común en personas que realizan actividad física regular. También se ha comprobado su efecto beneficioso en la evolución de la neumonía. Sin embargo, no se han establecido la dosis ni la posología necesarias para lograr estos efectos.[20]
Quienes defienden el suministro de altas dosis de vitamina C sostienen que la causa primaria de las enfermedades vasculares es la deficiencia de esta vitamina, lo que debilita la pared arterial de colágeno. Secundariamente en las fisuras resultantes de ese debilitamiento se forma la placa arterial de lipoproteína(a) como mecanismo de reparación. El engrosamiento de las placas causa a largo plazo un estrechamiento arterial y trombosis.
Esta teoría basa su credibilidad en el hecho de que los animales que sintetizan vitamina C no presentan lipoproteína(a) en sangre ni tampoco sufren la enfermedad coronaria. Únicamente las pocas especies que no producen vitamina C, entre ellas algunos primates y el hombre, presentan estos trastornos. Este importante hecho no es tenido en cuenta por los detractores de suministrar altas dosis de vitamina C para prevenir las enfermedades cardiovasculares.[cita requerida]
En modelos animales intoxicados con plomo, la vitamina C ha demostrado “efectos protectores” sobre las anormalidades musculares y nerviosas inducidas por la intoxicación con plomo. En fumadores, los niveles sanguíneos de plomo disminuyen un 81 % en promedio, cuando son suplementados con 1000 mg de vitamina C, mientras que 200 mg son inefectivos, sugiriendo que la vitamina C en suplementos puede ser una económica y conveniente ventaja para reducir niveles de plomo en sangre. La revista de la Asociación Americana Médica publicó un estudio en el que concluyó, basado en el análisis de los niveles de plomo sanguíneo en sujetos del estudio NHANES III (Third National Health Examination Survey), que la relación independiente e inversa entre los niveles de plomo y vitamina C en plasma, de ser causal, podría tener implicaciones públicas en salud para el control de la intoxicación por plomo.[21]
La vitamina C ha limitado su popularidad como tratamiento para los síntomas generados por el autismo. Un estudio en 1993, de 18 niños con autismo encontró la disminución de algunos síntomas posteriormente al tratamiento con vitamina C.[22]
Ensayos clínicos pequeños han encontrado que la vitamina C podría mejorar la cuenta, motilidad y morfología del esperma en hombres infértiles. Así como mejorar las funciones inmunes relacionadas con la prevención y tratamiento de enfermedades asociadas a la edad.[23]
Un estudio preliminar publicado en los Anuales de Cirugía de los EE. UU. encontró que la administración y suplementación con antioxidante usando α-tocoferol y ácido ascórbico reduce la incidencia de falla orgánica y acorta la estadía en UCI en este cohorte de pacientes quirúrgicos críticamente enfermos.[24]
Según un estudio de la Universidad de Soochow (China), podría existir una asociación menor, pero aun así algo significativa, entre vitamina C y un menor riesgo de embolia. Además, el ácido dehidroascórbico, la principal forma de la vitamina C oxidada en el cuerpo, ha demostrado reducir las deficiencias neurológicas y la mortalidad causadas como consecuencia de accidentes cerebrovasculares, debido a su habilidad para cruzar la barrera hematoencefálica, mientras que la vitamina C o el S-ascorbato no logra atravesar esta barrera. En un estudio publicado por el Proceedings of the National Academy of Sciences en el 2001, los autores concluyeron que “una estrategia farmacológica que incremente los niveles cerebrales de ascorbato en accidentados cerebrovasculares tiene un potencial enorme, cosa que se deduce de la oportuna investigación básica realizada y el resultado relevante en humanos con accidentes cerebrovasculares tratados con esta terapia".[25]
Vitamina C y producción de colágeno
editarEl colágeno es la proteína más abundante en el cuerpo humano actuando como un agente cohesivo que asegura la integridad estructural de los tejidos. Con insuficiente colágeno se observa una pérdida de elasticidad cutánea, la aparición acelerada de arrugas, y un aumento en la rigidez y dolor articular.[26]
La vitamina C es fundamental en la biosíntesis de colágeno debido a varios mecanismos:[27]
Funciona como un cofactor esencial en la hidroxilación de residuos de prolina y lisina, aminoácidos críticos para la estabilización de la triple hélice de colágeno. Sin la vitamina C este proceso enzimático clave se detiene y se compromete significativamente la producción de colágeno. [28]
Además la vitamina C es un antioxidante potente que protege las células del estrés oxidativo causado por radicales libres, que pueden dañar componentes celulares y acelerar los procesos de envejecimiento. Al neutralizar los radicales libres, la vitamina C preserva la integridad de la matriz extracelular y otros tejidos dependientes del colágeno.
Finalmente, la vitamina C promueve la proliferación de fibroblastos, células responsables de la síntesis de colágeno en la dermis, lo cual resulta en un aumento en la producción de colágeno y contribuye al mantenimiento de una piel más firme y estructuralmente resistente.
Vitamina C y cáncer
editarLos suplementos de vitamina C pueden interactuar con algunos medicamentos utilizados en el tratamiento contra el cáncer, reduciendo su efectividad.[29]
Un experimento del doctor Arthur Robinson sugirió que altas dosis de vitamina C, recibidas de manera artificial, podrían hacer que las largas exposiciones a la luz solar intensa fuesen más peligrosas de lo normal, incrementando así la posibilidad de desarrollar cáncer de piel.[30]
En enero del 2007, la Food and Drug Administration (FDA) aprobó un ensayo de toxicidad fase I para determinar dosis seguras de vitamina C intravenosa, como posible tratamiento para el cáncer en quienes se han agotado otros tratamientos y opciones convencionales.[cita requerida]
En febrero de 2007, un estudio no controlado de 39 pacientes con cáncer terminal, mostró que sobre cuestionarios subjetivos, los pacientes reportaron una mejoría en salud, síntomas del cáncer y funciones diarias después de la administración de altas dosis de vitamina C intravenosa. Los autores concluyeron que, «aunque existe todavía la controversia en relación con los efectos anticancerosos de la vitamina C, el uso de la misma es considerado una terapia segura y efectiva para mejorar la calidad de vida de pacientes con cáncer terminal».[31]
En agosto del 2008, un artículo publicado en Proceedings of the National Academy of Sciences por Mark Levine y colaboradores del Instituto Nacional de Diabetes y enfermedades del Riñón, encontraron que la inyección directa de altas dosis de vitamina C reduce el peso y crecimiento del tumor en 50 % en modelos de ratones con cáncer de ovario, cerebro y pancreático.[32]
Otra indicación no menos importante es el consumo por encima de la normalidad a efecto de su excreción en la orina y acidificarla, por el carácter ácido de esta vitamina. Con ello se pretende facilitar la eliminación en la orina y urea de compuestos más solubles en soluciones ácidas.[cita requerida]
En 2013 la revista Cochrane publicó que no se han hallado pruebas que relacionen el hecho de complementar la dieta con vitamina C con la reducción de desarrollar cáncer de pulmón ya sea en personas con buena salud o en personas de alto riesgo (fumadores y los que han sido expuestos al amianto).[33] Sin embargo, otro estudio realizado en 2014 concluyó que el consumo de vitamina C podría proteger del riesgo a desarrollar cáncer de pulmón.[34]
Vitamina C e inmunosenescencia
editarLa inmunosenescencia, el deterioro gradual del sistema inmunológico con la edad, es un fenómeno que compromete la capacidad del cuerpo para combatir infecciones y enfermedades. Un estudio reciente de la Universidad Médica de Guangzhou ha arrojado luz sobre la relación entre la ingesta de vitamina C y la longitud de los telómeros, sugiriendo un impacto significativo en la salud inmunológica y la longevidad celular.
Este estudio, llevado a cabo por la Universidad Médica de Guangzhou, investigó la asociación entre la ingesta de vitamina C y la longitud de los telómeros en una cohorte diversa. Los telómeros, que protegen los extremos de los cromosomas y previenen la degradación del ADN durante la división celular, son indicadores críticos de la salud celular. Su acortamiento está asociado con el envejecimiento y la inmunosenescencia.
El estudio encontró que los individuos con una mayor ingesta de vitamina C presentaban telómeros más largos en comparación con aquellos con ingestas más bajas. Esta longitud telomérica se correlaciona con una mayor capacidad de las células para dividirse sin sufrir mutaciones genéticas, lo que es crucial para la salud del sistema inmunológico.
La vitamina C, conocida por sus propiedades antioxidantes, protege los telómeros del daño oxidativo. Este daño es uno de los factores principales en el acortamiento telomérico y la disfunción celular que lleva a la inmunosenescencia. Además de su función antioxidante, la vitamina C participa en la reparación del ADN dañado. Esto es crucial para mantener la estabilidad genómica y la integridad telomérica, aspectos esenciales para una función celular óptima y una respuesta inmunitaria eficaz. La vitamina C también influencia la producción y función de varias células inmunitarias, incluyendo linfocitos y fagocitos, mejorando así la respuesta inmunológica. La preservación de telómeros largos en estas células inmunitarias es esencial para su capacidad de proliferación y función.
Los hallazgos de este estudio subrayan la importancia de una ingesta adecuada de vitamina C para la salud del sistema inmunológico y la prevención de la inmunosenescencia. Mantener niveles óptimos de vitamina C podría ser una estrategia viable para retardar el envejecimiento inmunológico y mejorar la resistencia a las enfermedades en la población anciana.
Requisitos diarios
editarEl ser humano parece ser extremadamente eficiente en la reutilización de la vitamina C, por lo que sus requisitos son 50 veces menores que en el resto de los primates. Al ser una vitamina hidrosoluble, su eliminación por el riñón por diuresis es extremadamente eficaz, por lo que los excesos se pueden eliminar en menos de cuatro horas. Sin embargo, hay una cierta transformación de ácido ascórbico a ácido oxálico y su sal oxalato de calcio, que es bastante insoluble y puede crear cálculos renales. Así 3 g de ascorbato ingeridos aparecen en la orina como ascorbato (90 %), dehidroascorbato (6 %) y metabolitos diversos como 31 mg de oxalato. Todo ello hace que haya muy poco consenso en cuál es la cantidad mínima y la cantidad máxima. Prueba de ello damos las siguientes referencias:
- 40 miligramos por día: Food Standards Agency del Reino Unido.
- 45 miligramos por día: la Organización Mundial de la Salud.[35]
- 60–95 miligramos por día: Academia Nacional de Ciencias de Estados Unidos. Según este organismo no se deben exceder los 2000 mg por día.
- 400 miligramos por día (mínimo): Instituto Linus Pauling.[36]
- 1 g por día: profesor Roc Ordman, para la investigación de los radicales libres.[37]
- 3 gramos por día (hasta 30 g para enfermos): Fundación para la vitamina C.[38]
- 6–12 gramos por día: Thomas E. Levy, Colorado Integrative Medical Centre.[39]
- 6–18 gramos por día: dosis que ingería Linus Pauling.[40]
- 3–200 gramos por día: Robert Cathcart va subiendo la dosis hasta que aparece una diarrea. Entonces, recomienda la dosis más elevada que no cause diarrea al paciente.[41]
Fuentes de vitamina C
editarTodas las frutas y verduras contienen alguna cantidad de vitamina C. En el siguiente listado aparecen aquellos con mayor concentración de vitamina C.[42]
Concentración de Vitamina C (mg/100 g)
Anécdotas
editarAunque es muy habitual creer que ayuda a recuperarse mejor de un resfriado o una gripe, un estudio realizado por científicos italianos refutó esta afirmación, pero muchos otros estudios, por el contrario, afirmaron que mejora la capacidad del sistema inmunitario.[43] Lo que sí se sabe es que el déficit (como el de otras vitaminas y compuestos esenciales) puede empeorar los síntomas y traer otras complicaciones. De todas formas la vitamina C es una de las vitaminas que intervienen en el funcionamiento del sistema inmunitario, como lo hacen la vitamina A y la tiamina. También es muy importante como vitamina antioxidante, lo que de una u otra manera protege a nuestro organismo de radicales libres u otras sustancias tóxicas. Por otro lado, al ser hidrosoluble, su exceso es fácilmente eliminado en la orina.
Como curiosidad, puede señalarse que la vitamina C solamente es esencial en algunos animales: los monos antropoides, el humano, otro mono antropoide que ha perdido la capacidad de sintetizarla naturalmente en su cuerpo; el ruiseñor chino, una especie de trucha, las cobayas (conejitos de indias o cuyes) y los murciélagos frugívoros.
Según el Centro Médico Langone de la Universidad de Nueva York (Estados Unidos), los principales alimentos que contienen vitamina C son las fresas (95 mg/taza), la papaya (85 mg/taza), el kiwi (70 mg/pieza), la naranja (70 mg/pieza) y el mango (45 mg/taza). En cuanto a verduras, el pimiento crudo —rojo o verde—, el brócoli y la col rizada también son ricos en esta vitamina. Algo más lejos quedan el aguacate (24 mg/pieza) y la alcachofa (30 mg/pieza).[44]
Véase también
editarReferencias
editar- ↑ Knight, John; Madduma-Liyanage, Kumudu; Mobley, James A.; Assimos, Dean G.; Holmes, Ross P. (agosto de 2016). «Ascorbic Acid Intake and Oxalate Synthesis» [Ingesta de ácido ascórbico y síntesis de oxalato]. Urolithiasis (en inglés) 44 (4): 289-297. PMID 27002809. doi:10.1007/s00240-016-0868-7. Consultado el 7 de diciembre de 2017.
- ↑ Camarena, Vladimir; Wang, Gaofeng (febrero de 2016). «The Epigenetic Role of Vitamin C in Health and Disease» [El rol epigenético de la vitamina C en la salud y la enfermedad]. Cell Mol Life Sci (en inglés) 73 (8): 1645-1658. PMID 26846695. doi:10.1007/s00018-016-2145-x. Consultado el 7 de diciembre de 2017.
- ↑ Wang, Juan; Zhang, Zhijin; Huang, Rongfeng (junio de 2013). «Regulation of ascorbic acid synthesis in plants» [Regulación de la síntesis de ácido ascórbico en plantas]. Plant Signal Behav (en inglés) (Taylor & Francis) 8 (6): e24536. PMID 23603957. doi:10.4161/psb.24536. Consultado el 9 de diciembre de 2017.
- ↑ a b c d e f g Gallie, Daniel R. (enero de 2013). «l-Ascorbic Acid: A Multifunctional Molecule Supporting Plant Growth and Development» [L-ácido ascórbico: una molécula multifuncional que soporta el crecimiento y desarrollo de las plantas]. Scientifica (Cairo) (en inglés) (Hindawi) 2013: 795964. PMID 24278786. doi:10.1155/2013/795964. Consultado el 9 de diciembre de 2017.
- ↑ a b Monacelli, Fiammetta; Acquarone, Erica; Giannotti, Chiara; Borghi, Roberta; Nencioni, Alessio (julio de 2017). «Vitamin C, Aging and Alzheimer’s Disease» [Vitamina C, envejecimiento y enfermedad de Alzheimer]. Nutrients (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 9 (7): 670. PMID 28654021. doi:10.3390/nu9070670. Consultado el 7 de diciembre de 2017.
- ↑ Higdon, Jane; Angelo, Giana; Frei, Balz; Michels, Alexander J.; Vazquez Lima, Silvia (noviembre de 2013). «Vitamina C». Oregon: Instituto Linus Pauling. Consultado el 8 de diciembre.
- ↑ Padayatty, Sebastian J.; Katz, Arie; Wang, Yaohui; Eck, Peter; Kwon, Oran; Lee, Je-Hyuk; et al (junio de 2003). «Vitamin C as an Antioxidant: Evaluation of Its Role in Disease Prevention» [Vitamina C como oxidante: evaluación de su rol en la prevención de enfermedades]. Journal of the American College of Nutrition (en inglés) (Informa UK Limited) 22 (1): 18-35. doi:10.1080/07315724.2003.10719272. Consultado el 7 de diciembre de 2017.
- ↑ a b «Ascorbic Acid». AHFS DI Essentials. Consultado el 9 de diciembre de 2017.
- ↑ Carr, Anitra C.; Maggini, Silvia (noviembre de 2017). «Vitamin C and Immune Function» [Vitamina C y la función inmune]. Nutrients (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 9 (11): 1211. PMID 29099763. doi:10.3390/nu9111211. Consultado el 10 de diciembre de 2017.
- ↑ Squires, Victor R. (2011). The Role of Food, Agriculture, Forestry and Fisheries in Human Nutrition - Volume IV (en inglés). EOLSS Publications. p. 121. ISBN 9781848261952.
- ↑ a b Bánhegyi, Gábor; Mandl, József (2001). The Hepatic Glycogenoreticular System [El sistema glicogenoreticular hepático] (en inglés) 7 (2). Budapest, Hungría: W. B. Saunders & Company Ltd. pp. 107-110. doi:10.1007/BF03032575. Consultado el 9 de diciembre de 2017.
- ↑ Challem, JJ, Taylor, EW. 1998. Retroviruses, ascorbate, and mutations, in the evolution of Homo sapiens. Free Radical Biology and Medicine. 25(1):130-132.
- ↑ Benhegyi, G. 1997. Ascorbate metabolism and its regulation in animals. Free Radical Biology and Medicine. 23(5):793-803.
- ↑ Stone I. 1979. Homo sapiens ascorbicus, a biochemically corrected robust human mutant. Medical Hypotheses. 5(6):711-721
- ↑ Vitamin C biosynthesis in prosimians: Evidence for the anthropoid affinity of Tarsius. J. I. Pollock 1, R. J. Mullin. American Journal of Physical Anthropology. 1986, v. 73 Issue 1, p. 65-70. Publicó online: 3 de mayo 2005: Digital Object Identifier (DOI) 10.1002/ajpa.1330730106, ver [1] visto 15 de marzo de 2010
- ↑ Dunitz, J. D. (1996). «Linus Carl Pauling». Biographical Memoirs of Fellows of the Royal Society (42): 316-326. doi:10.1098/rsbm.1996.0020.
- ↑ Brönnimann, C. et al. (1994): Direct oxidation of L-sorbose to 2-Keto-L-gulonic acid with molecular oxygen on Platinum- and Palladium-based catalysts. In: J. Catal. 150(1), S. 199–211; doi:10.1006/jcat.1994.1336
- ↑ "The production of vitamin C" (PDF). Competition Commission. 2001, visto 20 de febrero 2007.
- ↑ [2]
- ↑ Hemilä, Harri (abril de 2017). «Vitamin C and Infections» [Vitamina C e infecciones]. Nutrients (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 9 (4): 339. PMID 28353648. doi:10.3390/nu9040339. Consultado el 10 de diciembre de 2017.
- ↑ Simon, JA.; ES. Hudes. «Relationship of ascorbic acid to blood lead levels.». JAMA 281 (24): 2289-93. PMID 10386552.
- ↑ Dolske, MC.; J. Spollen; S. McKay; E. Lancashire; L. Tolbert (Sep de 1993). «A preliminary trial of ascorbic acid as supplemental therapy for autism.». Prog Neuropsychopharmacol Biol Psychiatry 17 (5): 765-74. PMID 8255984.
- ↑ Akmal, M.; JQ. Qadri, NS. Al-Waili, S. Thangal, A. Haq, KY. Saloom (2006). «Improvement in human semen quality after oral supplementation of vitamin C.». J Med Food 9 (3): 440-2. PMID 17004914. doi:10.1089/jmf.2006.9.440.
- ↑ Nathens, AB.; MJ. Neff, GJ. Jurkovich, P. Klotz, K. Farver, JT. Ruzinski, F. Radella, I. Garcia, RV. Maier (Dec de 2002). «Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients.». Ann Surg 236 (6): 814-22. PMID 12454520.
- ↑ Huang, J.; DB. Agus, CJ. Winfree, S. Kiss, WJ. Mack, RA. McTaggart, TF. Choudhri, LJ. Kim, J. Mocco, DJ. Pinsky, WD. Fox (Sep de 2001). «Dehydroascorbic acid, a blood-brain barrier transportable form of vitamin C, mediates potent cerebroprotection in experimental stroke.». Proc Natl Acad Sci U S A 98 (20): 11720-4. PMID 11573006. doi:10.1073/pnas.171325998.
- ↑ «Vitamin C and Skin Health». Linus Pauling Institute (en inglés). 7 de noviembre de 2016. Consultado el 25 de agosto de 2024.
- ↑ Spaccesi, Dr Martin Sanabria (27 de agosto de 2024). «¿Por qué la vitamina c es la mejor vitamina para promover la producción de colágeno? - Supreme Nutrients». supremenutrients.es. Consultado el 27 de agosto de 2024.
- ↑ Boyera, N.; Galey, I.; Bernard, B. A. (1998-06). «Effect of vitamin C and its derivatives on collagen synthesis and cross-linking by normal human fibroblasts». International Journal of Cosmetic Science 20 (3): 151-158. ISSN 0142-5463. PMID 18505499. doi:10.1046/j.1467-2494.1998.171747.x. Consultado el 27 de agosto de 2024.
- ↑ Ml, Heaney (1 de octubre de 2008). «Vitamin C Antagonizes the Cytotoxic Effects of Antineoplastic Drugs». Cancer research (en inglés). Consultado el 31 de mayo de 2020.
- ↑ http://nutritionandcancer.org/view/nutritionandcancer/oism_nac.pdf
- ↑ Yeom, CH.; GC. Jung, KJ. Song (Feb de 2007). «Changes of terminal cancer patients' health-related quality of life after high dose vitamin C administration.». J Korean Med Sci 22 (1): 7-11. PMID 17297243.
- ↑ Chen, Q.; MG. Espey, AY. Sun, C. Pooput, KL. Kirk, MC. Krishna, DB. Khosh, J. Drisko, M. Levine (Aug de 2008). «Pharmacologic doses of ascorbate act as a prooxidant and decrease growth of aggressive tumor xenografts in mice.». Proc Natl Acad Sci U S A 105 (32): 11105-9. PMID 18678913. doi:10.1073/pnas.0804226105.
- ↑ Cortés-Jofré M; Rueda JR; Corsini-Muñoz G; Fonseca-Cortés C; Caraballoso M; Bonfill Cosp X (2012). «(2012). "Drugs for preventing lung cancer in healthy people». Cochrane Database Syst Rev. (10). doi:10.1002/14651858.CD002141.pub2.
- ↑ Luo J; Shen L; Zheng D (2014). «Association between vitamin C intake and lung cancer: a dose-response meta-analysis». Science Report (4): 6161. doi:10.1038/srep06161.
- ↑ «Vitamin and mineral requirements in human nutrition, 2ª ed.». World Health Organization. 2004. Archivado desde el original el 29 de noviembre de 2007. Consultado el 20 de febrero de 2007.
- ↑ Higdon, Jane. «Linus Pauling Institute Recommendations». Oregon State University. Consultado el 11 de abril de 2007.
- ↑ Roc Ordman. «The Scientific Basis Of The Vitamin C Dosage Of Nutrition Investigator». Beloit College. Archivado desde el original el 2 de febrero de 2007. Consultado el 22 de febrero de 2007.
- ↑ «Vitamin C Foundation's RDA». Archivado desde el original el 8 de febrero de 2007. Consultado el 12 de febrero de 2007.
- ↑ Levy, Thomas E. (2002). Vitamin C Infectious Diseases, & Toxins. Xlibris. ISBN 1401069630. Chapter 5 - Vitamin C optidosing.
- ↑ Pauling, Linus (1986). How to Live Longer and Feel Better. W. H. Freeman and Company. ISBN 0-380-70289-4.
- ↑ Cathcart, Robert (1994). «Vitamin C, Titrating To Bowel Tolerance, Anascorbemia, and Acute Induced Scurvy». Orthomed. Archivado desde el original el 28 de abril de 2013. Consultado el 22 de febrero de 2007.
- ↑ Conver, Alicia (28 de mayo de 2019). «Alimentos con vitamina C». Consultado el 1 de enero de 2019.
- ↑ WHO Model Formulary 2008. World Health Organization. 2009. p. 496. ISBN 9789241547659. Consultado el 8 de diciembre de 2016.
- ↑ http://www.med.nyu.edu/
Enlaces externos
editar