Diosgenina
La diosgenina es un Δ5 espirostano obtenido por hidrólisis de la saponina dioscina. Se encuentra en abundancia significativa en las raíces de las especies Dioscorea composita y Dioscorea floribunda.
| Diosgenina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| (20α,22R,25R)-espirosta-5-en-3β-ol | ||
| General | ||
| Fórmula estructural |
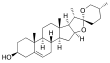 | |
| Fórmula molecular | C27H42O3 | |
| Identificadores | ||
| Número CAS | 512-06-1[1] | |
| ChEBI | 4629 | |
| ChEMBL | 412437 | |
| ChemSpider | 89870 | |
| PubChem | 99474 | |
| UNII | K49P2K8WLX | |
| KEGG | C08898 | |
|
O1[C@@H]4[C@H]([C@@H]([C@]12OC[C@@H](CC2)C)C)[C@@]5(C)CC[C@@H]3[C@@]6(C(=C/C[C@H]3[C@@H]5C4)\C[C@@H](O)CC6)C
| ||
| Propiedades físicas | ||
| Masa molar | 41 462 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Usos
editarDebido a su semejanza estructural, se utiliza como materia prima en la producción sintética de hormonas esteroidales.
Síntesis de esteroides
editarSíntesis del precursor común
editar1) Protección del doble enlace
editarComo primer paso de la síntesis de esteroides se procede a la protección del doble enlace con bromo (Br2).
2) Clivaje espiroacetálico
editarEl clivaje del sustituyente espiroacetal se produce con anhídrido acético a altas temperaturas.
3) Oxidación
editarSe produce la oxidación del doble enlace, abriéndose de este modo el anillo E.
4) Hidrólisis
editarCon una base en condiciones suaves se produce la hidrólisis de los ésteres y la posterior eliminación del protón del carbono 17, formándose un doble enlace. La 5α,6β-dibromo-3β-hidroxipregn-16-en-20-ona producida es el precursor común en la síntesis de hormonas esteroidales.
Referencias
editar- (20α,22R,25S)-Spirosta-5-ene-3β-ol. Chemical Book.