Clorato de potasio
El clorato de potasio o clorato potásico es una sal formada por el anión clorato y el catión potasio. En su forma pura forma cristales blancos. Es el clorato más común en la industria, y se encuentra en la mayoría de los laboratorios. Se emplea mayormente como oxidante, para realizar trabajos de pavonado y en la elaboración de pirotecnia y explosivos.
| Clorato de potasio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Trioxoclorato (V) de potasio | ||
| General | ||
| Otros nombres |
Clorato potásico Clorato de potasio | |
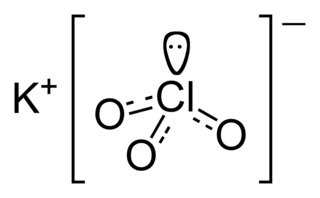
| Fórmula estructural |
 | |
| Fórmula molecular | KClO3 | |
| Identificadores | ||
| Número CAS | 3811-04-9[1] | |
| Número RTECS | FO0350000 | |
| ChEMBL | CHEMBL3188561 | |
| ChemSpider | 18512 | |
| PubChem | 6426889 | |
| UNII | H35KS68EE7 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 2.32 × 10³ kg/m³; 2,32 g/cm³ | |
| Masa molar | 122,55 g/mol | |
| Punto de fusión | 629 K (356 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 7.31 g/100 ml | |
| Peligrosidad | ||
| NFPA 704 |
0
2
3
OX
| |
| Compuestos relacionados | ||
| Aniones relacionados |
KBrO3 KIO3 | |
| Cationes relacionados |
NH4ClO3 NaClO3 | |
| Otros compuestos |
KCl KClO KClO2 KClO4 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El clorato de potasio por sí mismo es seguro a temperatura ambiente, sin embargo mezclado con materiales reductores o combustibles puede volverse sensible a la temperatura, y junto a elementos como el azufre y el fósforo se vuelve inestable, detonándose con la fricción o choque, por lo que fue utilizado para rellenar cápsulas fulminantes, y para su uso en elaboración de pirotecnia fue mayormente relegado por el perclorato de potasio, de mayor estabilidad.
Producción
editarA escala industrial, el clorato de potasio se produce mediante la reacción de metátesis de sal de clorato de sodio y cloruro de potasio
La reacción está impulsada por la baja solubilidad del clorato de potasio en agua. El equilibrio de la reacción se desplaza hacia la derecha debido a la precipitación continua del producto ( principio de Le Chatelier ). El precursor clorato de sodio se produce industrialmente en cantidades muy grandes mediante electrólisis del cloruro de sodio , la sal de mesa comúnmente
A veces también se utiliza la electrólisis directa de KCl en solución acuosa, en la que el cloro elemental formado en el ánodo reacciona con KOH in situ . La baja solubilidad del KClO 3 en agua hace que la sal se aísle convenientemente de la mezcla de reacción simplemente precipitando de la solución.
El clorato de potasio se puede producir en pequeñas cantidades mediante desproporción en una solución de hipoclorito de sodio seguida de una reacción de metátesis con cloruro de potasio:
También se puede producir pasando cloro gaseoso a una solución caliente de potasa cáustica:
Usos
editarEl clorato de potasio fue un ingrediente clave en los primeros casquillos de percusión (cebadores) de las armas de fuego. Continúa en esa aplicación, donde no es reemplazado por perclorato de potasio.
Los propulsores a base de clorato son más eficientes que la pólvora tradicional y son menos susceptibles al daño causado por el agua. Sin embargo, pueden ser extremadamente inestables en presencia de azufre o fósforo y son mucho más caros. Los propulsores de clorato deben utilizarse únicamente en equipos diseñados para ellos; El incumplimiento de esta precaución es una fuente común de accidentes. El clorato de potasio, a menudo en combinación con fulminato de plata , se utiliza en trucos que hacen ruido conocidos como "crackers", "snappers", "pop-its", "caps" o "bang-snaps", un tipo popular de fuegos artificiales novedosos .
Otra aplicación del clorato de potasio es como oxidante en una composición de humo como la que se utiliza en las granadas de humo. Desde 2005, se utiliza un cartucho con clorato de potasio mezclado con lactosa y colofonia para generar el humo blanco que señala la elección del nuevo Papa por un cónclave papal . [2]
Los laboratorios de escuelas secundarias y universidades suelen utilizar clorato de potasio para generar oxígeno gaseoso. Es una fuente mucho más barata que un tanque de oxígeno criogénico o presurizado. El clorato de potasio se descompone fácilmente si se calienta mientras está en contacto con un catalizador, típicamente dióxido de manganeso (IV) (MnO 2 ). Por lo tanto, puede simplemente colocarse en un tubo de ensayo y calentarse sobre un quemador. Si el tubo de ensayo está equipado con un tapón de un orificio y una manguera, se puede extraer oxígeno caliente. La reacción es la siguiente:
Calentarlo en ausencia de un catalizador lo convierte en perclorato de potasio :
Con un calentamiento adicional, el perclorato de potasio se descompone en cloruro de potasio y oxígeno:
La realización segura de esta reacción requiere reactivos muy puros y un control cuidadoso de la temperatura. El clorato de potasio fundido es un oxidante extremadamente poderoso y reacciona espontáneamente con muchos materiales comunes como el azúcar. Se han producido explosiones por salpicaduras de cloratos líquidos en los tubos de látex o PVC de los generadores de oxígeno y por el contacto entre los cloratos y las grasas selladoras de hidrocarburos. Las impurezas del propio clorato de potasio también pueden causar problemas. Cuando se trabaja con un nuevo lote de clorato de potasio, es aconsejable tomar una pequeña muestra (~1 gramo) y calentarla fuertemente sobre una placa de vidrio abierta. La contaminación puede hacer que esta pequeña cantidad explote, lo que indica que se debe desechar el clorato.
El clorato de potasio se utiliza en generadores químicos de oxígeno (también llamados bujías de clorato o bujías de oxígeno), empleados como sistemas de suministro de oxígeno, por ejemplo, en aviones, estaciones espaciales y submarinos, y ha sido responsable de al menos un accidente aéreo . Un incendio en la estación espacial Mir se debió a velas generadoras de oxígeno que utilizan un perclorato de litio similar. La descomposición del clorato de potasio también se utilizó para proporcionar oxígeno a los focos .
El clorato de potasio se utiliza también como pesticida . En Finlandia se vendió con el nombre comercial Fegabit.
El clorato de potasio puede reaccionar con el ácido sulfúrico para formar una solución altamente reactiva de ácido clórico y sulfato de potasio:
La solución así producida es suficientemente reactiva como para encenderse espontáneamente si hay presente material combustible (azúcar,papel, etc.).
En las escuelas, el clorato de potasio fundido se utiliza en las demostraciones de dulces que gritan , ositos de goma , Haribo y Trolli , donde los dulces se dejan caer en la sal fundida.
En los laboratorios químicos se utiliza para oxidar HCl y liberar pequeñas cantidades de cloro gaseoso.
Los insurgentes en Afganistán también utilizan ampliamente el clorato de potasio como componente clave en la producción de artefactos explosivos improvisados . Cuando se hicieron esfuerzos significativos para reducir la disponibilidad de fertilizantes de nitrato de amonio en Afganistán, los fabricantes de artefactos explosivos improvisados comenzaron a utilizar clorato de potasio como una alternativa barata y eficaz. En 2013, el 60% de los artefactos explosivos improvisados en Afganistán utilizaban clorato de potasio, lo que lo convierte en el ingrediente más común utilizado en los artefactos explosivos improvisados. El clorato de potasio también fue el ingrediente principal en el coche bomba utilizado en los atentados con bombas de Bali de 2002 que mataron a 202 personas.[3]
El clorato de potasio se utiliza para forzar la etapa de floración del árbol longan , lo que hace que produzca frutos en climas más cálidos.
Seguridad
editarEl clorato de potasio debe manipularse con cuidado. Reacciona vigorosamente y, en algunos casos, se enciende o explota espontáneamente cuando se mezcla con muchos materiales combustibles . Arde vigorosamente en combinación con prácticamente cualquier material combustible, incluso aquellos que normalmente son ligeramente inflamables (incluidos el polvo y la pelusa comunes). Las mezclas de clorato de potasio y un combustible pueden inflamarse por contacto con ácido sulfúrico, por lo que se debe mantener alejado de este reactivo. Se debe evitar el azufre en composiciones pirotécnicas que contengan clorato de potasio, ya que estas mezclas son propensas a la deflagración espontánea . La mayor parte del azufre contiene trazas de ácidos que contienen azufre, que pueden provocar una ignición espontánea: las "flores de azufre" o "azufre sublimado", a pesar de su alta pureza general, contienen cantidades significativas de ácidos sulfúricos. Además, las mezclas de clorato de potasio con cualquier compuesto con propiedades que promuevan la ignición (por ejemplo, trisulfuro de antimonio (III) ) son muy peligrosas de preparar, ya que son extremadamente sensibles a los golpes.
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ Daniel J. Wakin and Alan Cowell (13 de marzo de 2013). «New Round of Voting Fails to Name a Pope». The New York Times. Consultado el 13 de marzo de 2013.
- ↑ «Afghan bomb makers shifting to new explosives for IEDs». USAToday.com. 25 de junio de 2013. Consultado el 25 de junio de 2013.
