Ciclopropanona
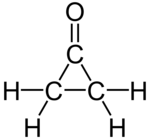
La ciclopropanona es un compuesto orgánico con fórmula molecular C3H4O en un esqueleto de ciclopropano que contiene un carbono con un grupo funcional cetona. El compuesto es lábil, con punto de fusión de −90 °C. Ha sido preparado por reacción de cetena con diazometano a −145 °C.[1][2][3]
| |
| Names | |
|---|---|
| Nombre IUPAC
ciclopropanona
| |
| Identifiers | |
Modelo 3D (JSmol)
|
|
| ChemSpider | |
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|
| |
| |
| Properties | |
| C3H4O | |
| Masa molar | 56.06326 |
| Densidad | 0.867 g/mL at 25 °C |
| Punto de fusión | −90 °C (−130 °F; 183 K) |
| Punto de ebullición | 50 a 53 °C (122 to 127 °F; 323 to 326 K) a 22 mmHg |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |

En síntesis orgánica, la ciclopropanona es sustituida por sintones equivalentes como sus acetales hemiacetal etil ciclopropanona[4] o etil trimetil silil ciclopropanona.[5]
Derivados
editarLas ciclopropanonas son intermediarias en la transposición de Favorskii con cetonas endocíclicas donde la formación del ácido carboxílico es simultánea a la contracción del anillo.
Una característica interesante de los derivados de la ciclopropanona es que ocurren reacciones de cicloadición como 1,3-dipolos. Para el caso, reaccionan con dienos heterocíclicos como el furano.[6][7] Como intermediario activo o como una estructura birradical se sugiere un tautómero intermedio oxialílico (formado por clivaje del enlace C2-C3. Compárese con el trimetilenmetano relacionado).
La evidencia experimental no es concluyente. Otras reacciones de ciclopropanonas pueden ocurrir a través de este intermediario. Para el caso de la (+)-trans-2,3-di-terbutilciclopropanona enantiopura, se observa racemización cuando se calienta a 80 °C.[8]
También se ha propuesto un intermedio oxialílico en la conversión fotoquímica de una 3,5-dihidro-4H-pirazol-4-ona con extrusión de nitrógeno a un indano:[9]
En esta reacción se forma un intermediario oxialílico, en un equilibrio químico en el cual la ciclopropanona B ataca al anillo fenílico mediante un carbocatión, generando un estado de transición 1,3-ciclohexadiénico C (con UV, la señal es similar al isotolueno), seguido por una rearomatización. La diferencia de energía entre A y B varía de 5 a 7 kcal/mol (21 a 29 kJ/mol).
Véase también
editar- Otras cetonas endocíclicas: ciclobutanona, ciclopentanona, ciclohexanona
- Otros derivados del ciclopropano: ciclopropeno, ciclopropenona
Referencias
editar- ↑ Preparation and characterization of cyclopropanone, methylcyclopropanone, 2,2-dimethylcyclopropanone and tetramethylcyclopropanone N. J. Turro and W. B. Hammond, Tetrahedron, Volume 24, Issue 18, 1968, Pages 6017-6028 doi 10.1016/S0040-4020(01)90985-8
- ↑ Cryochemical synthesis and molecular energetics of cyclopropanone and some related compounds E. F. Rothgery, R. J. Holt, H. A. McGee,, Jr. J. Am. Chem. Soc.; 1975; 97(17); 4971-4973. doi 10.1021/ja00850a034
- ↑ Cyclopropanones Nicholas J. Turro, Acc. Chem. Res.; 1969; 2(1); 25-32. doi 10.1021/ar50013a004
- ↑ Síntesis orgánicas, Coll. Vol. 7, p.131 (1990); Vol. 63, p.147 (1985). [Enlace http://www.orgsynth.org/orgsyn/pdfs/cv7p0131.pdf]
- ↑ Datasheet Enlace Archivado el 26 de septiembre de 2007 en Wayback Machine. de proveedor comercial
- ↑ Cyclopropanones. XII. Cycloaddition reactions of cyclopropanones Nicholas J. Turro, Simon S. Edelson, John R. Williams, Thomas R. Darling, Willis B. Hammond, J. Am. Chem. Soc.; 1969; 91(9); 2283-2292. doi 10.1021/ja01037a018
- ↑ Cyclopropanones. XVII. Kinetics of the cycloaddition reaction of cyclopropanones with 1,3-dienes Simon S. Edelson, Nicholas J. Turro J. Am. Chem. Soc.; 1970; 92(9); 2770-2773. doi 10.1021/ja00712a030
- ↑ Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone Frederick D. Greene, David B. Sclove, Jose F. Pazos, Ronald L. Camp J. Am. Chem. Soc.; 1970; 92(25); 7488-7488. doi 10.1021/ja00728a051
- ↑ First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone Andrey G. Moiseev, Manabu Abe, Evgeny O. Danilov, and Douglas C. Neckers, J. Org. Chem.; 2007; 72(8) pp 2777 - 2784; (Article) doi 10.1021/jo062259r
Enlaces externos
editar- Esta obra contiene una traducción derivada de «Cyclopropanone» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.