Ciclobutadieno
El ciclobutadieno es un compuesto orgánico cíclico con dos dobles enlaces (dieno) conjugados de fórmula C4H4. Es muy reactivo debido a su tendencia a dimerizarse. Aunque el compuesto original no se ha aislado, algunos derivados sustituidos son robustos y una sola molécula de ciclobutadieno es bastante estable. Como el compuesto se degrada por un proceso bimolecular a 1,3-butadieno, la especie solo se puede observar mediante técnicas de aislamiento en matrices inertes de gases inertes a bajas temperaturas (temperaturas inferiores a 35 K) quedando atrapada sin poder dimerizarse. A temperaturas superiores tiende a dimerizar por medio de la reacción de Diels-Alder, incluso a -78 °C. El isómero endo se forma preferentemente, mientras que el isómero exo se forma solo como un subproducto:[2][3][4]
| Ciclobutadieno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,3-Ciclobutadieno | ||
| General | ||
| Fórmula molecular | C4H4 | |
| Identificadores | ||
| Número CAS | 1120-53-2[1] | |
| ChEBI | CHEBI:33657 | |
| ChemSpider | 120626 | |
| PubChem | 136879 | |
| Propiedades físicas | ||
| Masa molar | 52 076 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
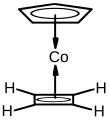
El ciclobutadieno es un ligando estable en muchos complejos metálicos. La razón de esto es que dos electrones se desplazan del metal a los orbitales del ligando, lo que da como resultado un sistema de 6 electrones-π aromáticos. Luego generalmente se puede separar del centro metálico oxidativamente (por ejemplo, por nitrato de cerio (IV)).[5][6]
Estructura química
editarEl compuesto es el hidrocarburo antiaromático prototípico con 4 electrones-π. Es el [n]-anuleno más pequeño ([4]-anuleno). Su estructura rectangular es el resultado del efecto Jahn-Teller, que distorsiona la molécula, convirtiendo el triplete en un estado fundamental de singlete.[7] Los estados electrónicos del ciclobutadieno se han explorado con una variedad de métodos computacionales.[8] La estructura rectangular es consistente con la existencia de dos isómeros de valencia de 1,2-dideutero-1,3-ciclobutadieno diferentes. Esta distorsión indica que los electrones pi están localizados, de acuerdo con la regla de Hückel que predice que un sistema π de 4 electrones no es aromático.
En principio, el ciclobutadieno podría asumir una geometría cuadrada sin distorsión, si adopta un estado de spin triple. Si bien es una posibilidad teórica, la forma de triplete del ciclobutadieno original y sus derivados sustituidos se mantuvo esquiva durante décadas. Sin embargo, en 2017, se observó espectroscópicamente el estado excitado de triplete cuadrado de 1,2,3,4-tetraquis(trimetilsilil)-1,3-ciclobutadieno, y se midió un gap singlete-triplete de EST = 13,9 kcal/mol para este compuesto.[9]
Síntesis y reactividad
editarEl ciclobutadieno se puede obtener por la descomposición de la 2-pirona. Después del cierre del anillo controlado térmicamente, el dieno se obtiene eliminando el CO2:
También se puede obtener por la liberación de los complejos metálicos con una sal de cerio.[5]
Además, el ciclobutadieno puede hacerse reaccionar con alquinos pobres en electrones. Primero se forma de benceno de Dewar, que luego se reorganiza lentamente para formar un derivado de benceno:[6]
El benceno Dewar se convierte en dimetil ftalato al calentar a 90 °C.
También se puede acceder a un derivado de ciclobutadieno a través de una cicloadición [2+2] de un di-alquino. En esta reacción particular, el reactivo de captura es el 2,3,4,5-tetrafenilciclopenta-2,4-dienona y uno de los productos finales (después de la expulsión del monóxido de carbono) es un ciclooctatetraeno:[10]
Referencias
editar- ↑ Número CAS
- ↑ Cram, Donald J.; Tanner, Martin E.; Thomas, Robert (1991). «The Taming of Cyclobutadiene Donald J. Cram, Martin E. Tanner, Robert Thomas». Angewandte Chemie International Edition in English 30 (8): 1024-1027. doi:10.1002/anie.199110241.
- ↑ Kollmar, H.; Staemmler, V. (1977). «A theoretical study of the structure of cyclobutadiene H. Kollmar, V. Staemmler; J. Am. Chem. Soc.». Journal of the American Chemical Society 99 (11): 3583-3587. doi:10.1021/ja00453a009.
- ↑ Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter Verlag, Berlin, 4. Auflage, 2011, S. 431, ISBN 978-3-11-024894-4.
- ↑ a b G. F. Emerson; L. Watts; R. Pettit (1965). «Cyclobutadiene- and Benzocyclobutadiene-Iron Tricarbonyl Complexes». J. Am. Chem. Soc. 87: 131-133. doi:10.1021/ja01079a032.
- ↑ a b R. Pettit; J. Henery (1970). «Cyclobutadieneiron tricarbonyl». Organic Syntheses 50: 21. doi:10.15227/orgsyn.050.0021.
- ↑ Peter Senn (1992). «A Simple Quantum Mechanical Model that Illustrates the Jahn-Teller Effect». J. Chem. Educ. 69 (10): 819. doi:10.1021/ed069p819.
- ↑ Balkova, A.; Bartlett, R. J. J. Chem. Phys. 1994, 101, 8972–8987.
- ↑ Kostenko, Arseni; Tumanskii, Boris; Kobayashi, Yuzuru; Nakamoto, Masaaki; Sekiguchi, Akira; Apeloig, Yitzhak (3 de julio de 2017). «Spectroscopic Observation of the Triplet Diradical State of a Cyclobutadiene». Angewandte Chemie International Edition (en inglés) 56 (34): 10183-10187. ISSN 1433-7851. PMID 28635054. doi:10.1002/anie.201705228.
- ↑ Chung-Chieh Lee; Man-kit Leung; Gene-Hsiang Lee; Yi-Hung Liu; Shie-Ming Peng (2006). «Revisit of the Dessy-White Intramolecular Acetylene-Acetylene [2 + 2] Cycloadditions». J. Org. Chem. 71 (22): 8417-8423. PMID 17064014. doi:10.1021/jo061334v.