Cianuro de calcio
El cianuro de calcio aparece como cristales o polvo blanco o polvo gris-negro (grado técnico).[2] Al igual que otros cianuros similares, es muy tóxico por absorción cutánea a través de heridas abiertas, por ingestión y por inhalación. Es un compuesto inorgánico con la fórmula Ca(CN)2. Es un sólido blanco, aunque rara vez se observa en forma pura. Las muestras comerciales suelen ser negro-grisáceas. Es la sal de calcio del cianuro de hidrógeno. Se hidroliza fácilmente (incluso en aire húmedo) para liberar cianuro de hidrógeno.[3]
| Cianuro de calcio | ||
|---|---|---|
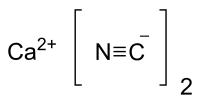 | ||
| Nombre IUPAC | ||
| Cianuro de calcio | ||
| General | ||
| Otros nombres | Dicianuro de calcio | |
| Fórmula estructural | Ca(CN)2 | |
| Fórmula molecular | CaC2N2 | |
| Identificadores | ||
| Número CAS | 592-01-8[1] | |
| ChemSpider | 11102 | |
| PubChem | 11590 | |
| UNII | 07DFJ2NTDD | |
|
[C-]#N.[C-]#N.[Ca+2]
| ||
| Propiedades físicas | ||
| Apariencia | blanco | |
| Densidad | 1853 kg/m³; 1,853 g/cm³ | |
| Masa molar | 92 113 g/mol | |
| Punto de fusión | 640 °C (913 K) | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Preparación
editarEl cianuro de calcio se puede preparar tratando el óxido de calcio (CaO) en polvo con ácido hidrociánico anhidro en ebullición en presencia de un acelerador como el amoníaco o el agua para minimizar la pérdida del ácido hidrociánico por polimerización:
También se puede preparar haciendo reaccionar ácido hidrociánico líquido con carburo de calcio. Alternativamente, el cianuro de calcio se puede preparar haciendo reaccionar ácido cianhídrico gas con cal viva (CaO) a altas temperaturas alrededor de 400 °C. A temperaturas más altas alrededor de 600 °C se forma cianimida de calcio en su lugar.[4] El material preparado a menudo está contaminado con derivados poliméricos de cianuro de hidrógeno, de ahí el color negro.
El cianuro de calcio se puede producir por azotación exotérmica de carburo de calcio a 1000 °C.[5] Surge como un intermediario en la producción de cianamida de calcio:
El cianuro de calcio también se produce en disolución acuosa haciendo reaccionar el ácido hidrociánico con hidróxido de calcio:[6]
Reactividad
editarEl cianuro de calcio se hidroliza fácilmente para formar gas de cianuro de hidrógeno. La presencia de ácido acelera la evolución del cianuro de hidrógeno. Es reactivo a los agentes oxidantes. El cianuro de calcio también se usa a veces para producir cianuro de amonio haciéndolo reaccionar con carbonato de amonio.
Usos
editarEl cianuro de calcio se usa casi exclusivamente en la industria minera. Sirve como una fuente económica de cianuro en muchas operaciones de lixiviación o tina para obtener metales preciosos como el oro y la plata de sus minerales.[7] Lo hace formando complejos de coordinación con los metales que los separan de los minerales.[8] Se distribuye en forma de escamas sólidas o en forma líquida.[7]
Referencias
editar- ↑ Número CAS
- ↑ . "Calcium Cyanide." Merriam-Webster Dictionary. 2001. http://www.merriam-webster.com/dictionary/calcium%20cyanide (accessed April 22, 2012).
- ↑ Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo and Manfred Sauer "Cyano Compounds, Inorganic" Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2004. doi 10.1002/14356007.a08_159.pub2
- ↑ "Production of Hydrocyanic Acid" United States Patent Office. 1933.
- ↑ Entrada en cianamida de calcio. En: Römpp Online . Georg Thieme Verlag. [1]
- ↑ Gail, E., Gos, S., Kulzer, R., Lorösch, J., Rubo, A., Sauer, M., Kellens, R., Reddy, J., Steier, N. und Hasenpusch, W (10 de 2011). «Cyano Compounds, Inorganic». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a08_159.
- ↑ a b "Use of Cyanide for the Gold Industry" International Cyanide Management Code for the Use of Cyanide in the Gold . 2011. http://www.cyanidecode.org/cyanide_use.php Archivado el 29 de febrero de 2012 en Wayback Machine. (accessed April 22, 2012).
- ↑ . "coordination compound" Encyclopædia Britannica. Encyclopædia Britannica Online Academic Edition. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.