Catalizador de Wilkinson
El catalizador de Wilkinson es el nombre común con el que se conoce al compuesto químico clorotris(trifenilfosfina) rodio (I ), un compuesto de coordinación de fórmula química RhCl(PPh3)3(Ph = fenilo). Recibe ese nombre en honor del fallecido químico organometálico y premio Nobel de Química en 1973, Sir Geoffrey Wilkinson que popularizó su uso.
| Catalizador de Wilkinson | ||
|---|---|---|
 | ||
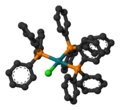 | ||
| Nombre IUPAC | ||
|
(SP-4)cloruro de tris(trifenilfosfina) rodio | ||
| General | ||
| Otros nombres | Catalizador de Wilkinson | |
| Fórmula semidesarrollada | RhCl(PPh3)3 | |
| Fórmula estructural |
| |
| Fórmula molecular | C54H45ClP3Rh | |
| Identificadores | ||
| Número CAS | 14694-95-2[1] | |
| Propiedades físicas | ||
| Apariencia | rojo | |
| Masa molar | 925,22 g/mol | |
| Punto de fusión | 718/−723 K (445/−996 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | no | |
| Solubilidad | benceno | |
| Peligrosidad | ||
| Frases S | S22 | |
| Compuestos relacionados | ||
| Otros compuestos |
trifenilfosfina Pd(PPh3)4 IrCl(CO)[P(C6H5)3]2 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura y propiedades básicas
editarEl compuesto posee geometría molecular plano cuadrada, y es un complejo con 16 electrones. Por lo general se obtiene en forma de un sólido cristalino de color rojo-violeta a partir de la reacción del cloruro de rodio (III) con exceso de trifenilfosfina. La síntesis se lleva a cabo en reflujo de etanol.[2] La trifenilfosfina sirve como agente reductor produciendo óxido de trifenilfosfina.
Aplicaciones catalíticas
editarEl catalizador de Wilkinson cataliza la hidrogenación de alquenos.[3][4] El mecanismo de esta reacción consiste en la disociación inicial de uno o dos ligandos trifenilfosfina para dar complejos de 14 o 12 electrones de valencia, respectivamente, seguido de la adición oxidativa de H2 al metal. A continuación, la Π-complejación del alqueno, la transferencia de hidruro intramolecular (inserción de olefinas), y una eliminación reductiva dan como resultado la formación del alcano correspondiente, por ejemplo,':
Otras aplicaciones del catalizador de Wilkinson incluyen la hidroboración catalizada de alquenos con catecolborano y pinacolborano,[5] y la 1,4-reducción selectiva de compuestos de carbonilo α,β-insaturados actuando conjuntamente con trietilsilano.[6] Cuando los ligandos trifenilfosfina se sustituyen por fosfinas quirales (por ejemplo, quirafos, DIPAMP, Diop), se convierte en un catalizador quiral y convierte los alquenos proquirales en alcanos enantioméricamente enriquecidos a través del proceso llamado hidrogenación asimétrica.[7]
Otras reacciones de RhCl(PPh3)3
editarEl compuesto RhCl(PPh3)3 reacciona con el CO para dar trans-RhCl(CO)(PPh3)2, que es estructuralmente similar al complejo de Vaska (pero mucho menos reactivo). El mismo complejo surge de la descarbonilación de aldehídos:
- RhCl(PPh3)3 + RCHO → RhCl(CO)(PPh3)2 + RH + PPh3
Tras agitación en solución de benceno, el RhCl(PPh3)3 se convierte en la especie poco soluble Rh2Cl2(PPh3)4, de color rojo. Esta conversión demuestra aún más la labilidad de los ligandos trifenilfosfina.
Referencias
editar- ↑ Número CAS
- ↑ Osborn, J. A.; Jardine, F. H.; Young, J. F.; Wilkinson, G. (1966). «The Preparation and Properties of Tris(triphenylphosphine)halogenorhodium(I) and Some Reactions Thereof Including Catalytic Homogeneous Hydrogenation of Olefins and Acetylenes and Their Derivatives». Journal of the Chemical Society A: 1711-1732. doi:10.1039/J19660001711.
- ↑ A. J. Birch, D. H. Williamson (1976). Organic Reactions 24: 1ff.
- ↑ B.R. James, Homogeneous Hydrogenation. John Wiley & Sons, New York, 1973.
- ↑ D. A. Evans, G. C. Fu and A. H. Hoveyda (1988). «Rhodium(I)-catalyzed hydroboration of olefins. The documentation of regio- and stereochemical control in cyclic and acyclic systems». J. Am. Chem. Soc. 110 (20): 6917-6918. doi:10.1021/ja00228a068.
- ↑ I. Ojima, T. Kogure (1972). «Selective reduction of α,β-unsaturated terpene carbonyl compounds using hydrosilane-rhodium(I) complex combinations». Tetrahedron Lett. 13 (49): 5035-5038. doi:10.1016/S0040-4039(01)85162-5.
- ↑ W. S. Knowles (2003). «Asymmetric Hydrogenations (Nobel Lecture 2001)». Advanced Synthesis and Catalysis 345 (12): 3-13. doi:10.1002/adsc.200390028.

