Deposición electroforética
La deposición electroforética es un término que engloba una amplia gama de procesos industriales que incluyen el recubrimiento electrolítico, la electrodeposición catódica, la electrodeposición anódica y el recubrimiento electroforético o pintura electroforética. Un rasgo característico de este proceso es que las partículas coloidales suspendidas en un medio líquido migran bajo la influencia de un campo eléctrico (electroforesis) y se depositan sobre un electrodo. [1]Todas las partículas coloidales que pueden utilizarse para formar suspensiones estables y que pueden llevar una carga pueden utilizarse en la deposición electroforética. Esto incluye materiales como polímeros, pigmentos, tintes, cerámicas y metales.
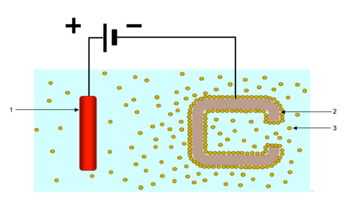
El proceso es útil para aplicar materiales a cualquier superficie conductora de la electricidad. Los materiales que se depositan son el principal factor determinante de las condiciones reales de procesamiento y del equipo que puede utilizarse.
Debido a la amplia utilización de los procesos de pintura electroforética en muchas industrias, la electrodeposición catódica acuosa es el proceso más utilizado comercialmente. Sin embargo, se conocen aplicaciones de deposición electroforética no acuosa. Actualmente se están explorando aplicaciones de electrodeposición catódica no acuosa para su uso en la fabricación de componentes electrónicos y la producción de recubrimientos cerámicos. Los procesos no acuosos tienen la ventaja de evitar la electrólisis del agua y la evolución del oxígeno que acompaña a la electrólisis.
Usos
editarEste proceso se utiliza industrialmente para aplicar revestimientos a productos metálicos fabricados. Se ha utilizado ampliamente para recubrir carrocerías y piezas de automóviles, tractores y maquinaria pesada, conmutadores eléctricos, electrodomésticos, muebles metálicos, envases de bebidas, cierres y muchos otros productos industriales.
Los procesos de electrodeposición catódica se aplican a menudo para la fabricación de fotocatalizadores de dióxido de titanio (TiO2) soportados para aplicaciones de purificación del agua, utilizando polvos precursores que pueden inmovilizarse mediante métodos de electrodeposición catódica sobre diversos materiales de soporte. Las películas gruesas producidas de este modo permiten una síntesis más barata y rápida que la de las películas finas sol-gel, además de mayores niveles de superficie fotocatalítica.
En la fabricación de pilas de combustible de óxido sólido, las técnicas electrodeposición catódica se emplean ampliamente para la fabricación de ánodos porosos de ZrO2 a partir de precursores en polvo sobre sustratos conductores.
Los procesos de electrodeposición catódica presentan una serie de ventajas que han hecho que estos métodos sean ampliamente utilizados.[2]
- El proceso aplica revestimientos que suelen tener un grosor muy uniforme y sin porosidad.
- Los objetos de fabricación compleja pueden recubrirse fácilmente, tanto en el interior de las cavidades como en las superficies exteriores.
- Velocidad de revestimiento relativamente alta.
- Pureza relativamente alta.
- Aplicabilidad a una amplia gama de materiales (metales, cerámica, polímeros, etc.).
- Fácil control de la composición del revestimiento.
- El proceso suele estar automatizado y requiere menos mano de obra que otros procesos de revestimiento.
- La utilización altamente eficiente de los materiales de revestimiento da como resultado costes más bajos en relación con otros procesos.
- El proceso acuoso que se utiliza habitualmente tiene menos riesgo de incendio en relación con los recubrimientos a base de disolventes a los que han sustituido.
- Los modernos productos de pintura electroforética son mucho más respetuosos con el medio ambiente que muchas otras tecnologías de pintura.
En varios laboratorios de investigación se han fabricado piezas cerámicas gruesas y complejas. Además, la electrodeposición catódica se ha utilizado para producir microestructuras personalizadas, como gradientes funcionales y laminados, mediante el control de la suspensión durante el procesamiento.[3]
Proceso
editarEl proceso industrial general de deposición electroforética consta de varios subprocesos:
- Preparación: suele consistir en algún tipo de proceso de limpieza y puede incluir la aplicación de un revestimiento de conversión, normalmente un revestimiento de fosfato inorgánico.
- El proceso de recubrimiento propiamente dicho: suele consistir en sumergir la pieza en un recipiente que contiene el baño o la solución de recubrimiento y aplicar corriente eléctrica continua a través del baño de deposición electroforética mediante electrodos. En las aplicaciones de recubrimiento electrolítico o pintura electroforética se suelen utilizar tensiones de 25 a 400 voltios de corriente continua. El objeto a recubrir es uno de los electrodos, y se utiliza un conjunto de "contraelectrodos" para completar el circuito.
- Tras la deposición, el objeto se enjuaga normalmente para eliminar el baño no depositado.
- Normalmente, tras el aclarado se utiliza un proceso de horneado o curado. Esto reticula el polímero y permite que el revestimiento, que será poroso debido a la evolución del gas durante el proceso de deposición, fluya y se vuelva liso y continuo.
Existen dos tipos de procesos de deposición electroforética: anódico y catódico. En el proceso anódico, el material cargado negativamente se deposita sobre el electrodo cargado positivamente, o ánodo. En el proceso catódico, el material cargado positivamente se deposita sobre el electrodo cargado negativamente, o cátodo.[4]
Cuando se aplica un campo eléctrico, todas las especies cargadas migran por el proceso de electroforesis hacia el electrodo con la carga opuesta. Existen varios mecanismos por los que se puede depositar material en el electrodo:
- Destrucción de la carga y la consiguiente disminución de la solubilidad.
- Coagulación por concentración.
- Salinización.
El principal proceso electroquímico que se produce durante la electrodeposición acuosa es la electrólisis del agua. Esto puede demostrarse mediante las siguientes dos reacciones medias que se producen en los dos electrodos:
Ánodo: 2H2O → O2(gas) + 4H(+) + 4e(-)
Cátodo: 4H2O + 4e(-) → 4OH(-) + 2H2(gas)
En la deposición anódica, el material que se deposita tendrá sales de un ácido como grupo portador de carga. Estos aniones cargados negativamente reaccionan con los iones de hidrógeno cargados positivamente (protones) que se producen en el ánodo por la electrólisis del agua para reformar el ácido original. El ácido totalmente protonado no tiene carga (destrucción de carga) y es menos soluble en agua, por lo que puede precipitar fuera del agua sobre el ánodo.
Una situación análoga ocurre en la deposición catódica, salvo que el material depositado tendrá sales de una base como grupo portador de carga. Si la sal de la base se ha formado por protonación de la base, la base protonada reaccionará con los iones hidroxilo que se forman por electrólisis del agua para dar lugar a la base cargada neutra (de nuevo destrucción de la carga) y al agua. El polímero no cargado es menos soluble en agua de lo que era cuando estaba cargado, y se produce la precipitación sobre el cátodo.
Deposición electroforética no acuosa
editarEn determinadas aplicaciones, como la deposición de materiales cerámicos, no pueden aplicarse tensiones superiores a 3-4V en la deposición electroforética acuosa si es necesario evitar la electrólisis del agua. Sin embargo, pueden ser deseables tensiones de aplicación más elevadas para conseguir mayores espesores de recubrimiento o para aumentar la velocidad de deposición. En tales aplicaciones, se utilizan disolventes orgánicos en lugar de agua como medio líquido. Los disolventes orgánicos utilizados son generalmente disolventes polares como alcoholes y cetonas. El etanol, la acetona y la metiletilcetona son ejemplos de disolventes que se han considerado adecuados para la deposición electroforética.
Referencias
editar- ↑ Katholieke Universiteit Leuven Information provider: K.U.Leuven, Department MTM. «Electrophoretic deposition». Archivado desde el original el 7 de septiembre de 2006. Consultado el 29 de octubre de 2023.
- ↑ Gurrappa, Injeti; Binder, Leo (2008). «Electrodeposition of nanostructured coatings and their characterization—A review». Science and Technology of Advanced Materials 9 (4): 043001. PMC 5099627. PMID 27878013. doi:10.1088/1468-6996/9/4/043001.
- ↑ Processing of ceramic materials – shaping Archivado el 7 de septiembre de 2006 en Wayback Machine. at Catholic University of Leuven
- ↑ Hanaor, Dorian; Michelazzi, Marco; Veronesi, Paolo; Leonelli, Cristina; Romagnoli, Marcello; Sorrell, Charles (2011). «Anodic aqueous electrophoretic deposition of titanium dioxide using carboxylic acids as dispersing agents». Journal of the European Ceramic Society 31 (6): 1041-1047. S2CID 98781292. arXiv:1303.2742. doi:10.1016/j.jeurceramsoc.2010.12.017.
Enlaces externos
editar- Esta obra contiene una traducción derivada de «Electrophoretic deposition» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.