Trióxido de carbono
El trióxido de carbono (CO3) es un óxido de carbono inestable (un oxocarbono). Tres posibles isómeros del trióxido de carbono, denotados Cs, D3h, y C2v, han sido más estudiados por métodos teóricos. El estado C2v ha demostrado ser el estado fundamental de la molécula.[1][2]
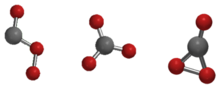
El trióxido de carbono (CO3) no debe confundirse con los iones carbonato estables (CO32−).
Formas de obtención
editarEl trióxido de carbono puede producirse, por ejemplo, en la zona de deriva del efecto corona negativo mediante reacciones entre dióxido de carbono (CO2) y el oxígeno atómico (O) creado a partir del oxígeno molecular (O2) por electrones libres en el plasma.[3]
Otro método reportado es la fotólisis del ozono O3 disuelto en CO2 líquido, o en las emisiones de mezclas CO2/SF6 a -45 °C, irradiados con luz de 2537 Å de longitud de onda (Correspondiente a la radiación ultravioleta). La formación de CO3 se infiere pero parece que decae de forma espontánea por la ruta 2CO3 → 2CO2 + O2 con una vida útil mucho menor de 1 minuto.[4]
El trióxido de carbono también puede obtenerse insuflando ozono en hielo seco (CO2 sólido), y ha sido detectado en las reacciones
Referencias
editar- ↑ Tim Kowalczyk, Electronic structure and spectroscopy of carbon trioxide
- ↑
T. Kowalczyk and A. I. Krylov, T; Krylov, AI (Aug de 2007). «Estructura electrónica y espectroscopia del trióxido de carbono e interacciones vibrónicas en las que participan estados de Jahn-Teller.». J. Phys. Chem. A 111 (33): 8271 - 8276. ISSN 1089-5639. PMID 17661455. doi:10.1021/jp073627d.
|last1=y|autor=redundantes (ayuda) - ↑ Sabin, J. R; Kim, H (1971). «Un estudio teórico de la estructura y propiedades del trióxido de carbono». Chemical Physics Letters 11 (5,): 593-597. doi:10.1016/0009-2614(71)87010-0.
- ↑ DeMore W. B., Jacobsen C. W. (1969). «La formación del trióxido de carbono en la fotólísis del ozono en dióxido de carbono líquido». Journal of Physical Chemistry 73 (9): 2935-2938. doi:10.1021/j100843a026.
Bibliografía adicional
editar- Sobek V., Skalný J. D. (1993). «A simple model of processes in the drift region of negative corona discharge in a mixture of air with halocarbons». Czechoslovak Journal of Physics 43 (8): 807. doi:10.1007/BF01589802. Archivado desde el original el 4 de enero de 2013.
- Pople J. A. , Seeger U., Seeger R., Schleyer P. v. R. (2004). «The structure of carbonate». Journal of Computational Chemistry 1 (2): 199-203. doi:10.1002/jcc.540010215.
- Moll N. G., Clutter D. R., Thompson W. E. (1966). «Carbonate: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2». The Journal of Chemical Physics 45 (12): 4469-4481. doi:10.1063/1.1727526.
- Gimarc B. M., Chou T. S. (1968). «Geometry and Electronic Structure of Carbon Trioxide». The Journal of Chemical Physics 49 (9): 4043-4047. doi:10.1063/1.1670715.
- DeMore W. B., Dede C. (1970). «Pressure dependence of carbon trioxide formation in the gas-phase reaction of O(1D) with carbon dioxide». Journal of Physical Chemistry 74 (13): 2621-2625. doi:10.1021/j100707a006.
- Francisco J. S., Williams I. H. (1985). «A theoretical study of the force field for carbon trioxide». Chemical Physics 95 (3): 373. doi:10.1016/0301-0104(85)80160-9.
Enlaces externos
editar- Esta obra contiene una traducción derivada de «Carbon trioxide» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.