Atmósfera (unidad)
La unidad de presión denominada atmósfera equivale a la presión que ejerce la atmósfera terrestre al nivel del mar. Se ha utilizado para medir presiones elevadas como, por ejemplo, la de los gases comprimidos. Esta unidad no pertenece al Sistema Internacional de Unidades y no tiene símbolo reconocido, pero suele abreviarse como atm.
| Atmósfera | ||
|---|---|---|
| Estándar | Sistema Internacional de Unidades | |
| Magnitud | Presión | |
| Símbolo | atm | |
| Equivalencias | ||
| Unidades del SI | 1 atm = 101 325 Pa | |
| U. T. de EE. UU. | 1 atm = 14,7 psi | |
En la X Conferencia General de Pesas y Medidas de 1954 fue definida como igual a 1 013 250 dinas por cm² (es decir 101 325 Pa).[1] Corresponde a la presión de una columna de mercurio de 760 mm de altura a 0 °C, bajo la aceleración de la gravedad normal (9,80665 m/s²).
La atmósfera técnica (símbolo at) también es una medida antigua de presión, definida como la presión ejercida por una columna de agua de 10 metros de altura: 1 at = 98 066,5 Pa (valor exacto).
Historia
editarLa atmósfera estándar se definió originalmente como la presión ejercida por una columna de 760 mm de mercurio en 0 grados Celsius (32,0 °F) y gravedad estándar (gn = 9.80665 m/s2).[2] Se utilizó como condición de referencia para la física y la química. propiedades, y estaba implícito en la definición de la escala de temperatura Celsius, que definía 100 °C como el punto de ebullición del agua a esta presión. En 1954, la décima Conferencia General de Pesas y Medidas (CGPM) adoptó la "atmósfera estándar" para uso general y afirmó que su definición es exactamente igual a 1013250 dinas. por centímetro cuadrado (101325 Pa).[3] Esto define la presión de una manera que es independiente de las propiedades de cualquier sustancia en particular. Además, la CGPM señaló que había habido un malentendido de que la definición anterior (de la 9ª CGPM) "llevaba a algunos físicos a creer que esta definición de atmósfera estándar era válida sólo para trabajos precisos en termometría".
En química y en varias industrias, la presión de referencia a la que se hace referencia en temperatura y presión estándar' era comúnmente 101,325 kPa (1 atm) antes de 1982, pero las normas han divergido desde entonces; en 1982, la Unión Internacional de Química Pura y Aplicada recomendó que, a efectos de especificar las propiedades físicas de las sustancias, la presión estándar fuera precisamente 100 kPa (1 bar).[4].
Fundamento
editarLa masa de aire que envuelve a la Tierra, la atmósfera, constituye el ejemplo más interesante de distribución de presión de un fluido compresible. El peso del aire que forma la atmósfera origina la llamada presión atmosférica. La presión atmosférica en un punto es numéricamente igual al peso de una columna de aire de área de sección recta unitaria que se extiende desde ese punto hasta el límite superior de la atmósfera. Como la densidad del aire atmosférico va disminuyendo al aumentar la altura, no resulta fácil hacer un cálculo exacto de la presión atmosférica sobre la superficie terrestre, pero, en cambio, resulta fácil medirla.
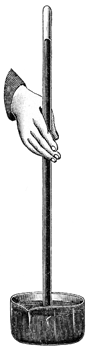
En 1643, Evangelista Torricelli (1608-47) ideó un método para medir la presión atmosférica y construyó el primer barómetro de mercurio. Dicho barómetro consiste, en esencia, en un tubo de vidrio, de un metro de longitud, cerrado por uno de sus extremos, que se llena completamente de mercurio. Evitando que se vierta el mercurio (tapando el extremo abierto), se invierte el tubo y se introduce su extremo abierto en una cubeta que contiene mercurio, situando el tubo en posición vertical, como se ilustra en la figura. Torricelli hizo esta experiencia y observó que el nivel del mercurio descendía dentro del tubo hasta que quedaba una columna (columna barométrica) de unos 760 mm de altura sobre el nivel del mercurio en la cubeta.
La diferencia de niveles (h) del mercurio en el tubo y en la cubeta permite calcular la presión atmosférica. El espacio que se forma sobre la columna de mercurio (cámara barométrica) solo contiene vapor de mercurio, cuya presión podemos despreciar por ser muy pequeña a las temperaturas ordinarias. Efectivamente, la presión que ejerce la atmósfera sobre la superficie del mercurio de la cubeta equilibra la presión de la columna de mercurio, luego, igualando ambas presiones, se obtiene la presión atmosférica pa dada por:
donde ρ es la densidad del mercurio a la temperatura correspondiente a la realización de la experiencia. Así, añadiendo una escala graduada que permita medir la longitud de la columna barométrica (y un termómetro de ambiente) se construye un barómetro de Torricelli.
Equivalencias
editarAplicaciones
editarEn química, las condiciones normales de temperatura y presión se definen por una temperatura de 0 °C y una presión de 1 atm. En 1990, la presión estándar cambió de 1 atm a 105 Pa (1 bar).
Es habitual, sobre todo en el buceo, equiparar una atmósfera con un bar.
| Pascal (Pa) | Bar (bar) | Atmósfera técnica (at) | Atmósfera estándar (atm) | Torr (mmHg) | Unidad PSI (psi) | |
|---|---|---|---|---|---|---|
| 1 Pa | ≡ 1 N/m2 | 10-5 | 10,197×10-6 | 9,8692×10−6 | 7,5006×10-3 | 145,04×10-6 |
| 1 bar | 100 000 | ≡ 106 dyn/cm2 | 1,0197 | 0,98692 | 750,06 | 14,504 |
| 1 at | 98 066,5 | 0,980665 | ≡ 1 kgf/cm2 | 0,96784 | 735,56 | 14,223 |
| 1 atm | 101 325 | 1,01325 | 1,0332 | ≡ 1 atm | 760 | 14,696 |
| 1 Torr | 133,322 | 1,3332×10-3 | 1,3595×10-3 | 1,3158×10-3 | ≡ 1 mmHg | 19,337×10-3 |
| 1 psi | 6894,76 | 68,948×10-3 | 70,307×10-3 | 68,046×10-3 | 51,715 | ≡ 1 lbf/in2 |
Véase también
editarReferencias
editar- ↑ «Résolutions de la X Conférence Générale des Poids et Mesures».
- ↑ Resnick, Robert; Halliday, David (1960). Física para estudiantes de ciencias e ingeniería Parte 1. Nueva York: Wiley. p. 364.
- ↑ «BIPM - Resolución 4 de la 10ª CGPM». www.bipm .org.
- ↑ IUPAC.org, Libro de Oro, Presión estándar]
Bibliografía
editar- Máximo, A. & Alvarenga, B (2004). Física General. México D.F.
- Ortega, Manuel R. (1989-2006). Lecciones de Física (4 volúmenes). Monytex. ISBN 84-404-4290-4.
- Resnick,R. and Halliday, D. (1996). Physics. John Wiley & Sons.
- Tipler, Paul A. (2000). Física para la ciencia y la tecnología (2 volúmenes). Barcelona: Ed. Reverté. ISBN 84-291-4382-3.
- Knight, PhD, Randall D. (2007). Physics for Scientists and Engineers: A Strategic Approach (google books) (en inglés estadounidense) (2nd edición). San Francisco: Pearson Addison Wesley. p. 1183. ISBN 978-0-321-51671-8. Consultado el 6 de abril de 2020.
- Giancoli, Douglas G. (2004). Physics: principles with applications. Upper Saddle River, N.J.: Pearson Education. ISBN 978-0-13-060620-4.
- McNaught, A. D.; Wilkinson, A.; Nic, M.; Jirat, J.; Kosata, B.; Jenkins, A. (2014). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). 2.3.3. Oxford: Blackwell Scientific Publications. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.P04819. Archivado desde el original el 4 de marzo de 2016.