Acetil-coenzima A acetiltransferasa
(Redirigido desde «Acetil-Coenzima A acetiltransferasa»)
La acetil-coenzima A acetiltransferasa (o tiolasa EC 2.3.1.9) es una enzima que cataliza la conversión de dos unidades de acetil-CoA en acetoacetil-CoA:
| Acetil-coenzima A acetiltransferasa 1 (acetoacetil coenzima A tiolasa) | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | ACAT1 (HGNC: 93) ACAT | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.3.1.9 | |||
| Locus | Cr. 11 q22.3-23.1 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Acetil-coenzima A acetiltransferasa 2 (acetoacetil coenzima A tiolasa) | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | ACAT2 (HGNC: 94) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.3.1.9 | |||
| Locus | Cr. 6 q25.3-q26 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||

Esta enzima es relevante en la ruta del mevalonato, una ruta metabólica importante, presente en todos los eucariotas superiores y muchas bacterias, que se esquematiza en el siguiente diagrama.
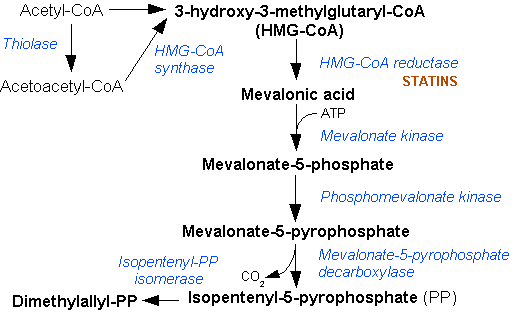
La familia de enzimas tiolasas catalizan la formación del enlace carbono-carbono a través de una condensación de Claisen dependiente de tioester.[1][2]
Genética humana
editarEl enzima está presente en dos formas en el organismo humano, denominadas respectivamente ACAT1 y ACAT2. ACAT1 está codificada por un gen localizado en el cromosoma 11. ACAT2 está codificada por un gen localizado en el cromosoma 6.
Referencias
editar- ↑ Heath RJ, Rock CO (octubre de 2002). «The Claisen condensation in biology». Nat Prod Rep 19 (5): 581-96. PMID 12430724.
- ↑ Haapalainen AM, Meriläinen G, Wierenga RK (enero de 2006). «The thiolase superfamily: condensing enzymes with diverse reaction specificities». Trends Biochem. Sci. 31 (1): 64-71. PMID 16356722. doi:10.1016/j.tibs.2005.11.011.