1,2,3-triazol
El 1,2,3-triazol es uno de los 2 compuestos químicos isómeros con fórmula molecular C2H3N3 llamados triazoles, que tienen un anillo de cinco miembros de dos átomos de carbono y tres átomos de nitrógeno. El 1,2,3-triazol es un heterociclo aromático.[2]
| 1,2,3-Triazol | ||
|---|---|---|
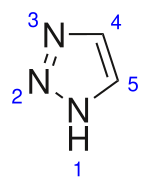 | ||
| Nombre IUPAC | ||
| 1H-1,2,3-triazol | ||
| General | ||
| Otros nombres | 2,3-diazapirrol | |
| Fórmula estructural |
 | |
| Fórmula molecular | C2H3N3 | |
| Identificadores | ||
| Número CAS | 288-36-8[1] | |
| ChEMBL | CHEMBL2148102 | |
| Propiedades físicas | ||
| Apariencia | líquido incoloro | |
| Densidad | 1192 kg/m³; 1,192 g/cm³ | |
| Masa molar | 690 654 g/mol | |
| Punto de fusión | 23/−25 °C (296/248 K) | |
| Punto de ebullición | 203 °C (476 K) | |
| Índice de refracción (nD) | 1,498 | |
| Propiedades químicas | ||
| Acidez | 1,2 pKa | |
| Alcalinidad | 9,4 pKb | |
| Solubilidad en agua | muy soluble | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Los 1,2,3-triazoles sustituidos pueden ser producidos usando una azida y un alquino por la reacción de Huisgen en la que se produce una reacción de cicloadición 1,3-dipolar.
El 1,2,3-triazol se usa en la investigación como un componente básico de compuestos químicos más complejos, como los fármacos tazobactam.
Síntesis
editarEl 1,2,3-triazol sustituido puede prepararse usando la Cicloadición de Huisgen azida-alquino, que es una cicloadición 1,3-dipolar entre un alquino y una azida. Se esquematiza en la siguiente figura:
La reacción no es regioselectiva: la fracción alquino R2 puede estar unido al átomo de carbono en la posición 4 o 5, como se muestra en la siguiente reacción:
También hay una variante que hace uso de un catalizador de cobre (I), por ejemplo cloruro de cobre (I) o yoduro de cobre (I), lo que permite que la reacción se pueda llevar a temperatura ambiente. Esa reacción es regioselectiva: simplemente da los triazoles 1,4-disustituidos.[3] Otra variación utiliza un complejo de rutenio como catalizador, tal como Cp*RuCl(PPh3)2, Cp*Ru(COD) y Cp*[RuCl4], estos dan lugar a la formación exclusiva de triazoles 1,5-disustituidos.[4][5] El mecanismo de reacción de estas variantes es diferente de la de la cicloadición de Huisgen anteriormente comentada.[6]
Propiedades
editarEl 1,2,3-triazol tiene dos tautómeros: el 1H y el 2-H:[7]
Es una estructura sorprendentemente estable en comparación con otros compuestos orgánicos con tres átomos de nitrógeno adyacentes. Sin embargo, la pirólisis flash al vacío a 500 °C conduce a la pérdida de nitrógeno molecular (N2) para producir aziridina. Ciertos triazoles son relativamente fáciles de escindir debido a la denominada tautomería cadena-anillo. Una manifestación se encuentra en la Transposición de Dimroth.
Bibliografía
editar- ↑ Número CAS
- ↑ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- ↑ Vsevolod V. Rostovtsev, Luke G. Green, Valery V. Fokin en K. Barry Sharpless. "A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective “Ligation” of Azides and Terminal Alkynes". Angewandte Chemie International Edition, Vol. 41 Nr. 14 (2002), 2596-2599. doi <2596::AID-ANIE2596>3.0.CO;2-4 10.1002/1521-3773(20020715)41:14<2596::AID-ANIE2596>3.0.CO;2-4
- ↑ Li Zhang, Xinguo Chen, Peng Xue, Herman H. Y. Sun, Ian D. Williams, K. Barry Sharpless, Valery V. Fokin, and Guochen Jia; (2005). «Ruthenium-Catalyzed Cycloaddition of Alkynes and Organic Azides». J. Am. Chem. Soc. 127 (46): 15998-15999. PMID 16287266. doi:10.1021/ja054114s.
- ↑ Brant C. Boren, Sridhar Narayan, Lars K. Rasmussen, Li Zhang, Haitao Zhao, Zhenyang Lin, Guochen Jia and Valery V. Fokin (2008). «Ruthenium-Catalyzed Azide−Alkyne Cycloaddition: Scope and Mechanism». J. Am. Chem. Soc. 130 (28): 8923-8930. PMID 18570425. doi:10.1021/ja0749993.
- ↑ Organic Chemistry Portal. Click Chemistry: Azide-Alkyne Cycloaddition
- ↑ Theophil Eicher, Siegfried Hauptmann, Andreas Speicher (2003). The Chemistry of Heterocycles: structure, reactions, syntheses, and applications. Wiley-VCH. ISBN 978-3-5273-0720-3.