Óxido de nitrógeno(I)
El óxido de nitrógeno(I), monóxido de dinitrógeno, óxido hiponitroso, protóxido de nitrógeno o anhídrido hiponitroso, también conocido como gas hilarante o gas de la risa (N2O), es un gas incoloro con un olor dulce y ligeramente tóxico, con efecto anestésico y disociativo.[2] No es inflamable ni explosivo, pero soporta la combustión tan activamente como el oxígeno cuando está presente en concentraciones apropiadas con anestésicos o material inflamable. Al ser el tercer gas de efecto invernadero de larga duración más importante, el óxido nitroso contribuye sustancialmente al calentamiento global y es una sustancia que agota sustancialmente el ozono estratosférico.[3]
| Óxido de nitrógeno(I) | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Monóxido de dinitrógeno | ||
| General | ||
| Otros nombres |
Óxido de nitrógeno(I) Óxido hiponitroso Gas hilarante Gas de la risa Protóxido de nitrógeno Anhídrido hiponitroso Nitro E-942 Azo-óxido | |
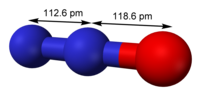
| Fórmula estructural | Ver imagen | |
| Fórmula molecular | N2O | |
| Identificadores | ||
| Número CAS | 10024-97-2[1] | |
| Número RTECS | QX1350000 | |
| ChEBI | 17045 | |
| ChEMBL | CHEMBL1234579 | |
| ChemSpider | 923 | |
| DrugBank | DB06690 | |
| PubChem | 948 | |
| UNII | K50XQU1029 | |
| KEGG | C00887 D00102, C00887 | |
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,2228 kg/m³; 0,0012228 g/cm³ | |
| Masa molar | 4401 g/mol | |
| Punto de fusión | 182,29 K (−91 °C) | |
| Punto de ebullición | 184,67 K (−88 °C) | |
| Temperatura crítica | 309,6 K (36 °C) | |
| Presión crítica | 71,503 atm | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,112 g en 100 g de agua | |
| Termoquímica | ||
| ΔfH0gas | 82,05 kJ/mol | |
| S0gas, 1 bar | 219,96 J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
OX
| |
| Riesgos | ||
| Inhalación | Puede causar asfixia. | |
| Piel | Peligroso comprimido o criogénico. | |
| Ojos | Peligroso comprimido o criogénico. | |
| Compuestos relacionados | ||
| Óxidos de nitrógeno relacionados | Óxido de nitrógeno(II), óxido de nitrógeno(IV), óxido de nitrógeno(VI), tetróxido de dinitrógeno, óxido de nitrógeno(V) | |
| Ácidos relacionados | Ácido hiponitroso, Ácido nitroso, ácido nítrico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
editarEl óxido de nitrógeno(I) se genera convenientemente por la termólisis controlada del nitrato de amonio o por reacción de amoníaco con ácido nítrico. Hay que controlar bien las condiciones de esta reacción porque existe el peligro de explosión. El óxido de nitrógeno(I) se forma también en condiciones anaeróbicas a partir de abonos minerales en el suelo. Es un gas que contribuye al efecto invernadero y tiene una permanencia media de 100 años en la atmósfera. Actualmente se atribuye el 5 % del efecto invernadero artificial a este gas. Además ataca la capa de ozono, reduciendo el ozono a oxígeno molecular y liberando dos moléculas de monóxido de nitrógeno.
Historia
editarA finales del siglo XVIII, Humphry Davy había leído el Tratado elemental de Lavoisier y eso lo condujo a practicar la química durante toda su vida. A los 19 años, en 1799 realizó muchos autoexperimentos, peligrosos, para estudiar el comportamiento de los gases tras inhalarlos. Esto en búsqueda de tratamientos nuevos, en especial para la tuberculosis. Davy falló, y casi murió, tras experimentar con el monóxido de carbono.[4]
En 1778, Thomas Beddoes fundó un "Instituto Neumático", y años más tarde contrató a Davy, de 19 años, para que lo ayudara. De esta manera siguió experimentando el efecto de los gases en su propio cuerpo. Años antes, ya se había logrado la reacción para obtener óxido nitroso: 2NO + H2O + Fe → N2O + Fe(OH)2. El monóxido de dinitrógeno se pensaba que era letal y se conocía que explotaba a altas temperaturas. Davy quería comprobar sus propiedades, así que calentó nitrato de amonio, recogió el gas que soltaba en fuelles hidráulicos y lo pasó por agua para purificarlo. Tras poner el gas en bolsas verdes de seda engrasadas y luego inhalarlo mientras un asistente de laboratorio le tomaba el pulso: Davy sintió un hormigueo placentero, en especial en su pecho y extremidades.[4] Después de administrar el mismo gas, las personas empezaron a sentir un hormigueo en cada dedo, además de un nuevo placer desconocido en la lengua.[5] El monóxido de dinitrógeno fue el primer indicio de que los sentimientos profundos del corazón y el cerebro podrían ser susceptibles a la química. Davy aumentó la dosis, se encerró en la caja de gas y recibió el monóxido de dinitrógeno cuarto por cuarto hasta alcanzar los ocho cuartos, además de otros 20 a través de la boquilla.[6] De esta manera observó el efecto analgésico del óxido nitroso y escribió sobre el mismo y su potencial para ser utilizado para operaciones quirúrgicas en su libro “Investigaciones Químicas y Filosóficas, principalmente sobre el monóxido de dinitrógeno” –aunque pasaron 44 años antes de que los médicos intentaran usarlo para anestesia.[4][6]
Usos en automovilismo
editarHoy en día este gas es utilizado en automóviles convencionales modificados. La cadena molecular del gas se rompe durante la combustión en la cámara, a unos 275 °C de temperatura, produciendo un aumento del oxígeno (sobrealimentación) disponible para la combustión con el consecuente aumento de potencia. Así mismo, el nitrógeno liberado presente en la cámara actúa como un amortiguador térmico tras el aumento de energía liberada. Las características en la entrega de potencia de los equipos de óxido nitroso limitan su uso en vehículos de serie a aumentos de potencia que normalmente no superan los 100 caballos y que más bien rondan entre los 50 y 75 caballos. Para el uso de mayores potencias se han diseñado sistemas progresivos de inyección del gas en cuestión, permitiendo así una rampa de aumento de potencia que evite las sobrecargas por shock en el conjunto motriz y la transmisión. Además para altas potencias es necesario la modificación de diversos componentes del motor. No se puede utilizar en cualquier automóvil sin antes modificar ciertas piezas.
El uso de equipos de óxido nitroso en vehículos de serie requiere una variación en la puesta a punto del avance de encendido, siendo necesario un atraso del mismo. También se recomienda el uso de bujías con un grado térmico mayor ("bujías frías"), lo cual asegura una mejor extracción del exceso de calor en la cámara para así evitar la detonación. Es necesario recordar que, debido al aumento de comburente en la cámara durante la inyección del gas, se necesita un aumento también del combustible inyectado hacia la cámara, para así mantener una relación aire/combustible adecuada.
Existen 3 tipos de sistemas de óxido nitroso: sistema de inyección húmeda, sistema en seco y sistema de puerto directo. El sistema en seco está basado en inyectar el nitro a través de los inyectores de combustible. En cambio, el sistema húmedo tiene un carburador con válvulas de tipo mariposa y añade el nitro al combustible en el mismo lugar y a la misma vez. El sistema de puerto directo es el más potente de todos ya que introduce el nitro y el combustible directamente en cada puerto de entrada del motor, este sistema generalmente añade el combustible y el óxido de nitroso a una manguera tipo Fogger, la encargada de mezclar ambos compuestos en cada cilindro del motor.
Farmacocinética
editarEl óxido nitroso es muy insoluble en sangre y otros tejidos, proveyendo de una inducción rápida de la anestesia y a la vez, rápida recuperación después de suspender el suministro. Es casi completamente eliminado por los pulmones, con una mínima difusión a través de la piel. No se biotransforma. Este gas quizás sea desintegrado por la interacción con la vitamina B12, presente en las bacterias intestinales. Esto resulta en una disminución en la síntesis de metionina, originando signos de deficiencia de vitamina B12 (anemia megaloblástica, neuropatía periférica) al utilizar óxido nitroso a largo plazo. Por esa razón no se utiliza como analgésico a largo plazo o como sedante en situaciones de cuidado intensivo. El óxido nitroso se ha convertido en una droga recreativa moderadamente popular en algunos países.[7][8][9]
Calentamiento global
editarEl óxido nitroso es un poderoso gas de efecto invernadero, por lo que a las emisiones de este gas se las responsabiliza parcialmente junto con el dióxido de carbono, el metano y algunos aerosoles, de provocar el calentamiento global.[10]
Datos adicionales
editar- Presión de vapor: 5150 kPa a 20 °C
- Solubilidad en agua: 1,305 l/l agua a 0 °C; 0,596 l/l agua a 25 °C
- Concentración máxima permitida en lugares de trabajo: 100 ppm
Referencias
editar- ↑ Número CAS
- ↑ [1] Datos de seguridad del óxido de nitrógeno(I) I.
- ↑ Thompson, R.L., Lassaletta, L., Patra, P.K. et al. Acceleration of global N2O emissions seen from two decades of atmospheric inversion. Nat. Clim. Chang. (2019) doi:10.1038/s41558-019-0613-7
- ↑ a b c La divertida historia del descubrimiento del gas de la risa. BBC News Mundo [Internet]. el 30 de diciembre de 2017 [citado el 12 de mayo de 2020]; Disponible en: https://www.bbc.com/mundo/noticias-42502691
- ↑ Rourke S. 12 descubrimientos accidentales clave en medicina [Internet]. Medscape. 2017 [citado el 12 de mayo de 2020]. p. 3. Disponible en: https://espanol.medscape.com/features/diapositivas/59000065#page=3
- ↑ a b Davy H. Researches, Chemical and Philosophical, Chiefly Concerning Nitrous Oxide, Or Dephlogisticated Nitrous Air, and Its Respiration. [Internet]. London: J. Johnson; 1800. Disponible en: https://books.google.com.ec/books?id=7IfOIIksmjwC
- ↑ van Amsterdam, Jan; Nabben, Ton; van den Brink, Wim (2015-12). «Recreational nitrous oxide use: Prevalence and risks». Regulatory toxicology and pharmacology: RTP 73 (3): 790-796. ISSN 1096-0295. PMID 26496821. doi:10.1016/j.yrtph.2015.10.017. Consultado el 26 de enero de 2021.
- ↑ Turner, Sally (30 de agosto de 2024). «Nitrous-Oxide: What is it good for?». Drug Science (en inglés). Consultado el 3 de octubre de 2024.
- ↑ «Nitrous Oxide». Drug Science (en inglés). Consultado el 3 de octubre de 2024.
- ↑ Thompson, R. L.; Lassaletta, L.; Patra, P. K.; Wilson, C.; Wells, K. C.; Gressent, A.; Koffi, E. N.; Chipperfield, M. P. et al. (18 de noviembre de 2019). «Acceleration of global N 2 O emissions seen from two decades of atmospheric inversion». Nature Climate Change (en inglés) 9 (12): 993-998. ISSN 1758-6798. doi:10.1038/s41558-019-0613-7. Consultado el 27 de noviembre de 2019.
Enlaces externos
editar- Erowid Nitrous Oxide Vault. Información y enlaces sobre el óxido de nitrógeno (en inglés).
- Instituto Nacional de Seguridad e Higiene en el trabajo de España. Ficha internacional de seguridad química del óxido de nitrógeno(I).
- Delegación del Gobierno para el Plan Nacional sobre Drogas, Ministerio de Sanidad, España Óxido nitroso o 'gas de la risa'.